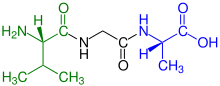Stickstoff
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Stickstoff (lateinisch Nitrogenium) ist ein chemisches Element mit der Ordnungszahl 7 und dem Elementsymbol N. Im Periodensystem steht es in der fünften Hauptgruppe bzw. der 15. IUPAC-Gruppe oder Stickstoffgruppe sowie der zweiten Periode. Das Symbol N leitet sich von der lateinischen Bezeichnung nitrogenium ab (von altgriechisch νίτρον nítron „Laugensalz“ und -gen, meist als „Salpeterbildner“ übersetzt). Die deutsche Bezeichnung Stickstoff erinnert daran, dass molekularer Stickstoff Flammen durch Verdrängen von Sauerstoff löscht („erstickt“) und dass in reinem Stickstoff Lebewesen ersticken, weil Sauerstoff fehlt. Ältere Bezeichnungen sind Azot oder Azotum, von denen sich weiterhin der Name einiger Stickstoffverbindungen ableitet, Stickgas und Zoogenium.
Elementar tritt Stickstoff nur in Form zweiatomiger Moleküle auf (molekularer Stickstoff, auch Distickstoff, Summenformel N2); er ist mit 78 % der Hauptbestandteil der Luft. In der Erdkruste kommt anorganisch gebundener Stickstoff selten vor; von Bedeutung ist er nur in Salpetervorkommen.
Im Laufe der Evolution hat sich ein Stickstoffkreislauf der Ökosysteme ausgebildet: Als Bestandteil von Proteinen und vielen anderen Naturstoffen ist Stickstoff essentiell für Lebewesen, die ihn in einem energieintensiven Prozess (Stickstofffixierung) organisch binden und bioverfügbar machen. Dies geschieht zum Beispiel enzymatisch an einem Eisen-Schwefel-Cluster, welcher ein Kofaktor des Enzyms Nitrogenase ist.
Geschichte

| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Stickstoff, N, 7 |
| Elementkategorie | Nichtmetalle |
| Gruppe, Periode, Block | 15, 2, p |
| Aussehen | Farbloses Gas |
| CAS-Nummer | |
| EG-Nummer | 231-783-9 |
| ECHA-InfoCard | |
| ATC-Code |
|
| Massenanteil an der Erdhülle | 0,03 % (17. Rang) |
| Physikalisch | |
| Aggregatzustand | gasförmig (N2) |
| Modifikationen | 1 |
| Kristallstruktur | hexagonal |
| Dichte | 1,250 kg/m3 bei 273,15 K |
| Magnetismus | diamagnetisch (χm = −6,7 · 10−9) |
| Schmelzpunkt | 63,05 K (−210,1 °C) |
| Siedepunkt | 77,15 K (−196 °C) |
| Verdampfungsenthalpie | 5,58 kJ/mol |
| Schmelzenthalpie | 0,36 kJ·mol−1 |
| Schallgeschwindigkeit | 333,6 m/s bei 298,15 K |
| Spezifische Wärmekapazität | 1040 J·kg−1·K−1 bei 298 K |
| Wärmeleitfähigkeit | 0,02583 W·m−1·K−1 |
| Chemisch | |
| Oxidationszustände | −3, −2, −1, 0, 1, 2, 3, 4, 5 |
| Elektronegativität | 3,04 (Pauling-Skala) |
Natürlich vorkommende chemische Verbindungen des Stickstoffs, wie Nitrate und Ammoniumsalze, wurden schon in der Antike und von den Alchimisten verwendet. Beide Verbindungstypen kann man neben ihrem Vorkommen als Mineralien auch aus Exkrementen herstellen. So stellten die Ägypter beispielsweise Ammoniumchlorid (Salmiak) aus Kamelmist her und Salpeter wurde lange Zeit aus dem Boden von Ställen gewonnen. Carl Wilhelm Scheele wies 1771 Stickstoff als Bestandteil der Luft nach – er bezeichnete ihn als „verdorbene Luft“ – und wurde im Jahr 1772 von Daniel Rutherford bestätigt. Antoine de Lavoisier gab dem Gas den Namen azôte (von altgriechisch ἄζωτος ázōtos „das Leben nicht unterstützend, lebensfeindlich“, also „erstickender, das Leben nicht unterhaltender Stoff“). Jean-Antoine Chaptal führte den Namen nitrogène ein (von lateinisch nitrogenium), nachdem man erkannt hatte, dass der Salpeter und die Salpetersäure Stickstoff-Verbindungen sind. Daher stammt die übliche Übersetzung „Salpeterbildner“ (nitrogenium ist abgeleitet von altgriechisch νίτρον nítron „Laugensalz“, das in der Antike verschiedene Salze im modernen Sinn bezeichnete – vergleiche die anfänglichen Ausführungen zur Geschichte des Natriums –, und -gen, gemeinsam „[Laugen-]Salzbildner“). Reiner Ammoniak wurde erstmals im Jahr 1774 von Joseph Priestley dargestellt. Das Luft Sauerstoff und Stickstoff in einem konstanten Verhältnis von etwa 1:4 enthält hatte Henry Cavendish 1783 erkannt.
Bis zum Anfang des 20. Jahrhunderts war Salpeter die einzige große Quelle von Stickstoffverbindungen. Durch die Einführung des Frank-Caro-Verfahrens (Kalkstickstofferzeugung nach Adolph Frank und Nikodem Caro) wurde der Luftstickstoff erstmals nutzbar gemacht. Das Birkeland-Eyde-Verfahren, nach Kristian Birkeland und Sam Eyde, diente der Gewinnung von Salpetersäure. Diese Verfahren wurden bald darauf abgelöst durch das Haber-Bosch-Verfahren, nach Fritz Haber und Carl Bosch, zur Synthese von Ammoniak aus Luftstickstoff und Wasserstoff sowie durch das katalytische Ostwaldverfahren nach Wilhelm Ostwald zur Umsetzung von Ammoniak zu Salpetersäure.
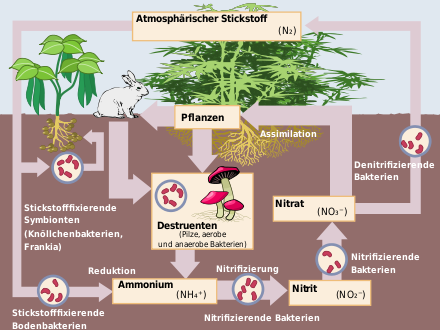
Natürliches Vorkommen und Kreislauf des Stickstoffs
Schon im 19. Jahrhundert erkannte man, dass ein großer Teil der pflanzlichen Materie Stickstoff enthält und er ein wichtiges Bauelement aller Lebewesen ist. Er ist das wesentliche Element der Proteine und Proteide (Eiweiße) und der DNS. Stickstoff ist daher auch Baustein aller Enzyme, die den pflanzlichen, tierischen und menschlichen Stoffwechsel steuern. Stickstoff ist für das Leben auf der Erde unentbehrlich.
Stickstoff in der Luft
Die Lufthülle der Erde besteht zu 78,09 Vol-% (75,53 % Gewichtsanteil) aus molekularem Stickstoff (Distickstoff N2). Lediglich eine kleine Anzahl von Mikroorganismen kann ihn nutzen, ihn in ihre Körpersubstanz einbauen oder auch an Pflanzen abgeben. Pflanzen können, soweit bekannt, den gasförmigen Stickstoff der Luft nicht unmittelbar nutzen. Die Überführung in eine Form, die von den Pflanzen verwertbar ist, geschieht durch:
- Knöllchenbakterien: Diese Bakterien dringen in die Wurzeln der sogenannten Leguminosen ein. Sie ernähren sich von den Assimilaten der Pflanze. Im Tausch dafür liefern sie der Wirtspflanze Ammonium. Dieses wurde durch ein spezielles Enzym, der Nitrogenase, unter hohem Energieaufwand aus dem Luftstickstoff reduziert. Diese Lebensgemeinschaft ist eine Symbiose. Sie ermöglicht den Leguminosen die Besiedelung auch schlechter Standorte, weshalb der Mensch diese Pflanzen insbesondere im ökologischen Landbau zur Anreicherung des Bodens mit Stickstoff nutzt. Hier stellen Leguminosen die Hauptstickstoffquelle dar.
- Freilebende Mikroorganismen: Die nichtsymbiotische Stickstoffbindung beruht auf der Fähigkeit einiger freilebender Mikroorganismen (zum Beispiel Azotobacter und Cyanobakterien), Luftstickstoff zum Aufbau von körpereigenem Eiweiß zu verwenden. Bei ackerbaulicher Nutzung wird die Größenordnung der Bindung von atmosphärischem Stickstoff durch freilebende Mikroorganismen mit 5–15 kg/ha und Jahr angenommen.
- Elektrische Entladung bei Gewittern: In niederschlagsreichen Gebieten können jährlich 20–25 kg N pro ha durch Regen dem Boden zugeführt werden. Das geschieht bei elektrischen Entladungen, wenn sich Sauerstoff und Stickstoff zu Stickstoffoxiden verbinden. Letztendlich reagieren diese Oxide mit dem Regenwasser zu Salpetersäure und im Boden können Nitrate entstehen.
- Ammoniaksynthese: Die Chemiker Fritz Haber und Carl Bosch haben zu Anfang des 20. Jahrhunderts ein Verfahren entwickelt, mit dem aus Luftstickstoff und Wasserstoff Ammoniak hergestellt werden kann. Die durch das Haber-Bosch-Verfahren möglich gewordene Nutzung des Stickstoff der Atmosphäre hat zur wesentlichen Ertragssteigerung landwirtschaftlicher Produktionen beigetragen. Die Ernährungssicherung konnte damit wesentlich verbessert werden. Die Pflanze baut aus dem aufgenommenen Ammoniak pflanzliches Eiweiß auf, das Mensch und Tier als Nahrung und zum Aufbau des eigenen Körpereiweißes dient. Im menschlichen und tierischen Organismus wird das Eiweiß zum großen Teil wieder abgebaut und mit dem Kot und Harn ausgeschieden. Zum heutigen Zeitpunkt wurde im Schnitt bereits jedes dritte Stickstoffatom in der Biosphäre einmal von der Düngemittelindustrie verarbeitet.
- Autoabgase: Durch die Verbrennung fossiler Energieträger (Benzin, Diesel) werden durch den Autoverkehr Stickstoffverbindungen freigesetzt. Bei dem Verbrennungsvorgang entstehen Stickoxide (NOx, vor allem Stickstoffdioxid NO2, aber auch Stickstoffmonoxid NO und andere NOx-Verbindungen). In der Vergangenheit wurden diese direkt in die Umgebung entlassen. Heutzutage besitzen Autos Katalysatoren, welche diese Verbindungen reduzieren: NOx wird im Katalysator zu Ammoniak reduziert. Dieses wird im Beisein von Wasser in Ammonium umgewandelt (Ammoniak/Ammonium-Gleichgewicht in angesäuerter Lösung: NH3 + H3O+ ⇔ NH4+ + H2O). Sowohl die oxidierten als auch die reduzierten Stickstoffverbindungen werden über die Luft verfrachtet und tragen zu einem beträchtlichen Teil zur Eutrophierung benachbarter Ökosysteme bei.
Stickstoff im Boden
In der Ackerkrume (A-Horizont) liegen meist mehr als 95 % des Gesamtstickstoffs als organisch gebundener Stickstoff in lebender Wurzelmasse, abgestorbener Pflanzenmasse, Humusstoffen und Bodenlebewesen vor. Der Rest von weniger als 5 % ist anorganischer Stickstoff in Form von Ammonium oder Nitrat und in sehr geringer Menge in Form von Nitrit. Dieser mineralische Stickstoffgehalt wird im Frühjahr vor der Düngung mit der Nmin-Methode bestimmt. Der Gesamtstickstoffgehalt der Böden ist stark von deren Kohlenstoffgehalt abhängig. Er wird durch Klima, Vegetation, Bodenart, Geländegestalt und Maßnahmen des Landwirts, wie Bodenbearbeitung, beeinflusst.
Stickstoff in Pflanzen
Aufgaben in der Pflanze
Stickstoff wird in die Photosyntheseprodukte eingebaut, um unter anderem Eiweiße herzustellen, und fördert so das Wachstum. Eine wichtige Bedeutung kommt dem Stickstoff als essentieller Bestandteil der Desoxyribonukleinsäure und des Chlorophylls zu. Je nach Art liegt der Anteil der Trockensubstanz bei 2–6 %, oder bei durchschnittlich 1,5 %. Die Aufnahme des Stickstoffs erfolgt meist in Form von Ammonium- oder Nitratsalzen.
Mangelsymptome
- kümmerlicher Wuchs
- blassgrüne Farbe der Blätter. Ältere werden chlorotisch und fallen vorzeitig ab.
- zu frühes Blühen (Notblüte)
- Vergilbungen
Überschusssymptome
- Mastiger Wuchs
- Blätter dunkelgrün
- Blüte verzögert
- Pflanze frost- und krankheitsanfällig
- Blattgewebe wirkt schwammig und weich
Gewinnung und Darstellung
Primär wird Stickstoff heute durch die fraktionierte Destillation verflüssigter Luft in Luftzerlegungsanlagen nach dem Linde-Verfahren mit einer Reinheit von bis zu 99,99999 % gewonnen. Stickstoff mit Verunreinigungen unter 1 ppb erfordert zusätzliche Reinigungsschritte. Für das Entfernen des verbliebenen Sauerstoffs existiert eine biologische Methode unter Verwendung von Reiskeimlingen.
Stickstoff mit einem Reinheitsgrad von ca. 99 % wird wesentlich kostengünstiger durch mehrstufige Adsorption/Desorption an Zeolithen erhalten. Eine weitere Methode zur dezentralen Gewinnung von Stickstoff ist das Membranverfahren. Hierbei wird Druckluft mit einem Druck von 5 bis 13 bar durch eine Kunststoffmembran gepresst. Die Diffusionsgeschwindigkeit von Stickstoff und Argon durch diese Membran ist deutlich langsamer als jene von Sauerstoff, Wasser und Kohlendioxid, dadurch wird der Gasstrom auf der Innenseite der Membran mit Stickstoff angereichert. Durch Anpassung der Durchströmgeschwindigkeit kann die Reinheit des Stickstoffs gesteuert werden (bis 99,995 % bei Kleinstmengen, 99 % bei industriellen Maßstäben.)
Eine etwas altertümliche Methode ist das Binden des Luftsauerstoffs unter Erhitzen an Kohle und das anschließende Auswaschen des entstandenen Kohlenstoffdioxids. Der Luftsauerstoff kann auch durch das Überleiten der Luft über glühendes Kupfer oder durch eine alkalische Pyrogallol- bzw. Natriumdithionitlösung entfernt werden.
Im Labor kann reiner Stickstoff durch Erhitzen einer wässrigen Ammoniumnitritlösung oder einer Lösung des Gemisches Ammoniumchlorid/Natriumnitrit auf etwa 70 °C dargestellt werden:
Alternativ ist eine Thermolyse von Natriumazid möglich, die zur Herstellung von spektroskopisch reinem Stickstoff verwendet wird.
Eigenschaften
Physikalische Eigenschaften
| Oxidationszustände von Stickstoff | |
|---|---|
| −3 | NH3, NaNH2, Li3N, HCN, Methylamin |
| −2 | N2H4 |
| −1 | N2H2, Hydroxylamin |
| 0 | N2 |
| +3 | HNO2, NaNO2, Nitromethan |
| +5 | HNO3, NaNO3 |
Molekularer Stickstoff ist ein farb-, geruch- und geschmackloses Gas, welches bei tiefen Temperaturen (−196 °C) zu einer farblosen Flüssigkeit kondensiert. Stickstoff ist in Wasser wenig löslich (23,2 ml Stickstoff in 1 l Wasser bei 0 °C) und nicht brennbar. Stickstoff ist das einzige Element der Stickstoffgruppe, das mit sich selbst (p-p)π-Bindungen bildet. Der Atomabstand dieser Dreifachbindung beträgt 109,8 pm.
In einer Gasentladungs-Spektralröhre werden bei einem Restdruck von ca. 5–10 mbar die Molekülorbitale des Stickstoffs beim Betrieb mit 1,8 kV Hochspannung, 18 mA Stromstärke und einer Frequenz von 35 kHz zum Leuchten angeregt. Bei der Rekombination der ionisierten Gasmoleküle wird hierbei das charakteristische Farbspektrum abgestrahlt.
Der kritische Punkt liegt bei: Temperatur 126,19 K (−146,95 °C), Druck 33,9 bar, Dichte 0,314 g/cm3. Der Tripelpunkt liegt bei: Temperatur: 63,15 K (−210 °C), Druck 0,125 bar.
Stickstoff geht in seinen Verbindungen vorzugsweise kovalente Bindungen ein. In der 2s2p3 Elektronenkonfiguration führt die Bildung von drei Kovalenzen zur Oktett-Komplettierung; Beispiele hierfür sind:
Alle diese Verbindungen haben eine trigonale pyramidale Struktur und ein freies Elektronenpaar. Über dieses freie Elektronenpaar können sie als Nukleophile und als Basen reagieren.
Der molekulare Distickstoff N2 ist durch die im Stickstoffmolekül vorhandene stabile Dreifachbindung und die damit verbundene hohe Bindungsdissoziationsenergie von 942 kJ/mol sehr reaktionsträge. Deswegen braucht es in der Regel einen hohen Energieaufwand, um diese Verbindung zu trennen und Stickstoff an andere Elemente zu binden. Hoch ist auch die erforderliche Aktivierungsenergie, die gegebenenfalls durch geeignete Katalysatoren verringert werden kann.
Polymerer Stickstoff
In einer Veröffentlichung im August 2004 gaben Forscher vom Max-Planck-Institut für Chemie in Mainz bekannt, dass sie unter Drücken von über 110 GPa bei einer Temperatur von über 2000 K eine neue kristalline Form, sogenannten polymeren Stickstoff mit Einfachbindungen erzeugt haben. Diese Modifikation besitzt eine einzigartige kubische Struktur, die sogenannte „cubic gauche“-Struktur. Durch die hohe Instabilität sind die Einsatzmöglichkeiten begrenzt, man könnte sich polymeren Stickstoff aber zum Beispiel als Sprengstoff oder Energiespeicher vorstellen. Polystickstoff wäre dann mit Abstand der stärkste nicht-nukleare Sprengstoff.
Eine dem schwarzen Phosphor analoge polymere Form des Stickstoffs, als Schwarzer Stickstoff bezeichnet wurde 2020 beschrieben. Die Struktur enthält zweidimensionale Schichten, in denen die Stickstoffatome über ein einheitliches Zickzack-Muster vernetzt sind. Diese 2D-Schichten ähneln in ihren elektronischen Eigenschaften dem Graphen, so dass das Material für viele technische Anwendungen interessant sein könnte. Die Herstellung erfolgte durch Lasererhitzung von Stickstoff bei einem Druck von 140 GPa in einer Diamantzelle.
Isotope
Es sind insgesamt 16 Isotope zwischen 10N und 25N sowie weitere Isomere des Stickstoffs bekannt. Von diesen sind zwei, die Isotope 14N und 15N, stabil und kommen in der Natur vor. Das Isotop mit dem größeren Anteil an der natürlichen Isotopenzusammensetzung ist 14N mit 99,636 %, 15N hat einen Anteil von 0,364 %. Die langlebigsten instabilen Isotope sind 13N, das mit einer Halbwertszeit von 9,965 Minuten unter β+-Strahlung in 13C übergeht, und 16N, das mit einer Halbwertszeit von 7,13 Sekunden unter Betazerfall zu 16O zerfällt. Alle anderen Isotope haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.
Das 15N-Isotop wurde von Naude (1929) entdeckt und schon wenige Jahre später von Norman und Werkman (1943) in ersten Feldversuchen eingesetzt. Auch heute noch wird dieses Isotop in ähnlicher Weise für biochemische Untersuchungen des Stickstoffstoffwechsels im Ackerboden oder in Pflanzen, aber auch bei der Umsetzung von Proteinen als Indikator eingesetzt. Der Anteil von 15N am Stickstoff der Atmosphäre beträgt 0,3663 %.
Anreichern kann man 15N wie andere Isotope gasförmiger Stoffe zum Beispiel durch Thermodiffusionstrennung.
Verwendung
Stickstoffverbindungen
Seit Beginn des 20. Jahrhunderts kann Luftstickstoff technisch fixiert werden: Die großtechnische Kalkstickstoff-Synthese begann um 1901, die der Salpetersäure nach dem Birkeland-Eyde-Verfahren um 1905 und die des Ammoniaks (Haber-Bosch-Verfahren) ab 1908.
Stickstoffverbindungen finden mannigfaltige Anwendungen im Bereich der organischen Chemie und dienen als Düngemittel.
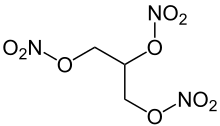
Viele Sprengstoffe sind Stickstoffverbindungen. Es handelt sich dabei um Nitroverbindungen oder Salpetersäureester. Bei ausreichend vielen Nitrogruppen im Molekül, z.B. bei Pikrinsäure, können die Sauerstoffatome der Nitrogruppen bei Anregung durch Schlag oder Temperaturerhöhung mit den Kohlen- oder Wasserstoffatomen im selben Molekül exotherm reagieren. Somit wird aus dem Feststoff in sehr kurzer Zeit ein Gas hoher Temperatur, das sich mit großer Gewalt ausdehnt. Sprengstoffe befinden sich also in einem metastabilen Zustand. Bei wenigen Nitrogruppen erfolgt lediglich eine schnelle und unvollständige Verbrennung, z.B. bei Nitrocellulose (u.a. Zelluloid).
Stickstoffgas

Stickstoff wird zur Füllung von Flugzeugreifen großer Flugzeuge verwendet. Das Vermeiden von Sauerstoff (etwa zu 21 % in Luft enthalten) bei etwa 10 bar Druck verhindert, dass Flugzeugreifen unter der großen Hitzeentwicklung (durch Reibung und Walken) bei Landung oder beim Startlauf von innen in Brand geraten können. Ein kleiner günstiger Nebeneffekt ist, dass Stickstoff etwa 2,5 % leichter als Luft ist.
Stickstoff dient als Schutzgas beim Schweißen und als Glühlampen-Füllgas. Die Inert-Eigenschaften des Stickstoffs sind hier von Bedeutung. Als Treibgas, Packgas, Gas zum Aufschlagen von Sahne und ähnlichem ist es als Lebensmittelzusatzstoff E 941 zugelassen.
Stickstoff findet in Getränkezapfanlagen Verwendung, wenn auf Grund von baulichen Umständen (langer Leitungsweg, großer Höhenunterschied) ein hoher Zapfdruck notwendig wird. Stickstoff wird hier zusammen mit Kohlenstoffdioxid als Mischgas verwendet. Da sich Stickstoff nicht im Getränk löst, kann auch bei höheren Drücken ohne zu viel Schaumbildung bzw. Aufcarbonisierung gezapft werden.
Stickstoff hat bei gleichem erhöhten Druck eine geringere Löslichkeit in – stets wasserbasierten – Getränken als Kohlenstoffdioxid. Durch Entspannen beim Zapfen werden dadurch kleinere Schaumbläschen erreicht. Da Stickstoff im Gegensatz zu CO2 den pH-Wert nicht reduziert, also nicht säuernd wirkt, können auch Milchmix- und Kaffeegetränke ohne Geschmacksveränderung in Richtung sauer geschäumt werden.
Als Mittel zur Exekution der Todesstrafe hat der US-amerikanische Bundesstaat Oklahoma im April 2015 den Einsatz von Stickstoffgas zum Ersticken gesetzlich zugelassen.
Flüssigstickstoff
Aufgrund des niedrigen Siedepunkts wird flüssiger Stickstoff als Kältemedium in der Kryotechnik eingesetzt. Der Stickstoff entzieht dabei dem Kühlgut seine Verdampfungsenthalpie und hält dieses solange kalt, bis er verdampft ist. Gegenüber flüssigem Sauerstoff, der bei −183 °C (90 K) siedet, ist der Siedepunkt von flüssigem Stickstoff um weitere 13 K niedriger, er siedet bei −196 °C (77 K) und bringt Luftsauerstoff und andere Gase zur Kondensation, die auf diese Weise getrennt werden können.
Flüssiger Stickstoff (Dichte 0,8085 kg/L bei −195,8 °C) wird unter anderem dazu verwendet, bei Hochtemperatursupraleitern den supraleitenden Zustand zu erzeugen. Er wird auch zur Lagerung biologischer und medizinischer Proben, Eizellen und Sperma, sowie zum Schockfrieren von biologischem Material verwendet. Ein Beispiel ist auch die Kühlung von Infrarot-Fotoempfängern, um deren thermisches Rauschen zu verringern oder überhaupt erst einen halbleitenden Zustand in ihnen herbeizuführen.
Im Tiefbau dient er der Bodenvereisung. Im Bereich der Werkstofftechnik benutzt man Flüssigstickstoff, um Restaustenit in bestimmten gehärteten Stählen zu beseitigen oder die Werkstoffe durch „Tiefkühlen“ künstlich zu altern. Flüssiger Stickstoff wird auch eingesetzt, um zum Beispiel Getriebewellen so weit zu schrumpfen, dass aufgesetzte Zahnräder durch Presspassung auf der Welle halten. Beim Recycling von Kabeln wird der Isolierstoff durch Kühlen mit flüssigem Stickstoff spröde und kann vom Metall (Aluminium bzw. Kupfer) abgeschlagen werden.
Bei der (in Deutschland nicht zugelassenen) „Stickstoffbestattung“ (Promession) wird der Leichnam in einem Bad aus flüssigem Stickstoff eingefroren und anschließend zu einem Pulver zermahlen.
Stickstoffverbraucher bekommen Stickstoff oft statt in Druckgasflaschen als Flüssigstickstoff in Thermobehältern ähnlich einer Thermosflasche bereitgestellt. Diese Behälter bezeichnet man als Dewargefäß. Der Stickstoff wird dazu flüssig aus ebenfalls doppelwandigen Tankfahrzeugen abgefüllt.
Chemische Reaktionen
Als Azotierung bezeichnet man eine chemische Reaktion, bei der ein Reaktionspartner Stickstoff aufnimmt.
Ein typisches Beispiel für eine Azotierung ist die Darstellung von Kalkstickstoff:
Sicherheit
Obwohl Luft zu über 78 % aus Stickstoff besteht und Stickstoff ein Inertgas und somit ungiftig ist, müssen bei der Handhabung von gasförmigem Stickstoff in größeren Mengen Sicherheitsmaßnahmen getroffen werden. Beispielsweise wenn aufgrund der Menge an Stickstoff die Gefahr besteht, dass Personen Arbeitsbereiche wie Maschinenräume betreten, welche aus Brandschutzgründen mit Stickstoffgas gefüllt sind, und durch Verdrängung kein oder nur eine ungenügende Menge an Sauerstoff für die Atmung vorhanden ist. Betritt eine Person einen solchen Bereich, kommt es zu einer heimtückischen, da durch die betroffene Person nicht bewusst wahrnehmbaren, normobaren Hypoxie durch Stickstoff, welche nach einigen Sekunden zu leichten Bewusstseinsstörungen gefolgt von Bewusstlosigkeit und nach wenigen Minuten zum Tod durch Erstickung führt. So kam es beispielsweise im Vorfeld der ersten Mission des Space Shuttle im März 1981 zum Tod zweier Techniker, welche einen aus Brandschutzgründen mit Stickstoff gefüllten Bereich in der Mobile Launcher Platform betreten hatten.
Der Grund für diese Gefahr liegt darin, dass der menschliche Körper über keine hinreichend schnelle Sensorik im Glomus caroticum zur Erkennung der Unterversorgung mit Sauerstoff verfügt. Das Gefühl von Erstickung tritt bei einem Anstieg des Kohlendioxidgehalts im Blut auf, gefolgt von heftigem Atemreflex und Panik. Kann hingegen das Kohlendioxid in einer reinen Stickstoffatmosphäre problemlos abgeatmet werden, was in größeren mit Stickstoff gefüllten Räumen der Fall ist, kommt es zu keinem wahrnehmbaren Erstickungsgefühl und die Unterversorgung mit Sauerstoff führt zur vom Betroffenen nicht bewusst wahrnehmbaren Hypoxie.
Daher müssen in Bereichen, in denen mit größeren Mengen Stickstoff hantiert wird und die potentielle Gefahr einer Erstickung beispielsweise bei Fehlfunktionen besteht, neben der nötigen Belüftung auch spezielle Warneinrichtungen vorhanden sein, die einen Sauerstoffmangel optisch oder akustisch anzeigen. Zusätzlich kann das Tragen einer persönlichen Schutzausrüstung nötig sein, welche das Unterschreiten des Sauerstoffgehalts unter einen Grenzwert rechtzeitig anzeigt.
Nachweis
Stickstoff, der in organisch gebundener Form vorliegt, kann qualitativ mittels Lassaignescher Probe und quantitativ mittels der Stickstoffbestimmung nach Will-Varrentrapp, der Kjeldahlschen Stickstoffbestimmung, über ein Azotometer oder die Elementaranalyse erfasst werden. Für anorganisch gebundenen Stickstoff werden als Nachweisreaktion die Kreuzprobe für Ammoniumionen oder die Ringprobe für Nitrationen durchgeführt. Zur Durchführung der Ringprobe wird die Probelösung (schwefelsauer, schwermetallfrei) mit frischer Eisen(II)-sulfat-Lösung versetzt und mit konzentrierter Schwefelsäure unterschichtet. An der Grenzfläche zwischen beiden Flüssigkeiten werden die Nitrationen zu Stickstoffmonoxid (NO) reduziert. Dieses Radikal bildet in wässriger Lösung mit weiteren Eisenionen einen braunen Komplex, der als „Ring“ an der Phasengrenze im Reagenzglas sichtbar wird:
Schritt 1:
sowie Schritt 2:
Verbindungen

Ammoniak
Ammoniak ist ein stark stechend riechendes, farbloses, wasserlösliches und giftiges Gas, das zu Tränen reizt und erstickend wirkt. Es ist der Grundstoff zur Herstellung anderer Stickstoffverbindungen, zum Beispiel Harnstoff, Ammoniumsalze wie Ammoniumnitrat und Ammoniumchlorid, Amide und Imide. Die Herstellung von Ammoniak erfolgt fast ausschließlich mit dem Haber-Bosch-Verfahren.
Nitride
Stickstoff bildet mit anderen Elementen verschiedene Arten von Nitriden:
- Kovalente Nitride wie Dischwefeldinitrid, Tetraschwefeltetranitrid, Siliciumnitrid und Bornitrid
- Metallische Nitride wie Titannitrid und Chromnitrid
- Salzartige Nitride wie Lithiumnitrid und Magnesiumnitrid
Titannitrid hat eine Natriumchlorid-Kristallstruktur. Es dient für Beschichtungen, die die Lebensdauer von Produkten, zum Beispiel Werkzeugen, verlängern. Diese goldfarbenen Schichten sind üblicherweise sehr dünn.
Siliciumnitrid tritt in drei Modifikationen (α-Si3N4, β-Si3N4 und γ-Si3N4) auf, die sich in ihrer Kristallstruktur unterscheiden. Es wird in der Halbleitertechnik und für Messspitzen von Rasterkraftmikroskopen verwendet.
Stickoxide
Bei Oxidationsprozessen, zum Beispiel bei der Verbrennung von Benzin, Erdöl und Kohle entstehen Stickoxide. Stickstoffquelle kann die Luft oder der Brennstoff sein. Einige Stickoxide, zum Beispiel Stickstoffdioxid, Stickstoffmonoxid und Distickstofftetroxid, sind giftig, ätzend und gesundheitsschädlich. Stickstoffdioxid und Distickstofftetroxid sind teilweise für den sauren Regen verantwortlich. Distickstoffmonoxid (Lachgas) wird als Narkosemittel eingesetzt. Es schädigt die Ozonschicht und ist ein sehr starkes Treibhausgas.
Halogenide
Stickstofftrifluorid ist ein starkes Oxidationsmittel. Es wird zur Herstellung von Halbleitern, Flachbildschirmen und Solarzellen verwendet. Iodstickstoff (Stickstofftriiodid) ist eine sehr instabile Verbindung, die hochexplosiv ist und bei Reibung, Schlag oder Erschütterung stark exotherm reagiert.
Säuren und deren Salze
Salpetersäure ist eine starke Säure, die unter anderem zur Herstellung von Düngemitteln, Farbstoffen und Sprengstoffen verwendet wird. Die Salze der Salpetersäure sind die Nitrate. Ammoniumnitrat, Natriumnitrat, Kaliumnitrat und Calciumnitrat sind wichtige Düngemittel.
Salpetrige Säure ist eine mittelstarke, instabile Säure, die bei Erwärmung in einer Disproportionierungsreaktion zu Salpetersäure, Stickstoffmonoxid und Wasser zerfällt:
Die Salze der Salpetrigen Säure sind die Nitrite. Natriumnitrit und Kaliumnitrit werden als Konservierungsmittel eingesetzt.
Hyposalpetrige Säure ist eine schwache, instabile Säure, die bereits bei Zimmertemperatur zu Distickstoffmonoxid und Wasser zerfällt:
Stickstoffwasserstoffsäure ist eine instabile, hochexplosive, die Schleimhäute reizende, stechend riechende Flüssigkeit. Die Salze der Stickstoffwasserstoffsäure heißen Azide. Bleiazid wird als Initialsprengstoff verwendet.
Weitere anorganische Verbindungen
Cyanwasserstoff (Blausäure) ist eine farblose bis leicht gelbliche, brennbare, sehr flüchtige und wasserlösliche Flüssigkeit. Cyanwasserstoff und seine Salze, die Cyanide, zum Beispiel Kaliumcyanid und Natriumcyanid, sind hochgiftig.
Weitere stickstoffhaltige Säuren sind Cyansäure, Isocyansäure und Knallsäure.
Organische Verbindungen
Stickstoff ist in zahlreichen organischen Verbindungen enthalten, zum Beispiel
- Organische
Aminoverbindungen
- Amine wie Spermin
- Aminosäuren, Peptide und Proteine
- Azoverbindungen
- Azobenzol
- Azofarbstoffe wie Anilingelb
- Nitroverbindungen und Salpetersäureester
- Nitromethan
- Sprengstoffe wie Nitroglycerin, Trinitrotoluol (TNT) und Octanitrocuban
- Stickstoffhaltige Heterocyclen wie Pyridin oder Indigo
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- N.N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.11. 2025