
Methylamin
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK | ||||||||||
| Toxikologische Daten | 100 mg/kg (LD50, Ratte, oral)[1] | |||||||||
Methylamin ist eine organisch-chemische Verbindung aus der Stoffgruppe der primären aliphatischen Amine. Es kommt als 40%ige wässrige Lösung, als druckverflüssigtes Gas und in Form des festen Salzes Methylammoniumchlorid in den Handel.
| Strukturformel | ||
|---|---|---|
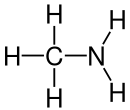
| ||
| Allgemeines | ||
| Name | Methylamin | |
| Andere Namen | ||
| Summenformel | CH5N | |
| Kurzbeschreibung | farbloses Gas mit ammoniakartigem Geruch[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 200-820-0 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| DrugBank | | |
| Eigenschaften | ||
| Molare Masse | 31,06 g/mol | |
| Aggregatzustand | gasförmig[1] | |
| Dichte | ||
| Schmelzpunkt | −93,5 °C[1] | |
| Siedepunkt | −6,3 °C[1] | |
| Dampfdruck | ||
| pKS-Wert | 10,66 (25 °C, konjugierte Säure)[2] | |
| Löslichkeit | ||
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −22,5 kJ/mol[6] | |
Geschichte
Der deutsche Chemiker Heinrich Debus synthetisierte 1863 Methylamin durch katalytische Hydrierung von Cyanwasserstoff an Platin.[7]
Vorkommen
Methylamin kommt in Bingelkräutern (Mercurialis), im ätherischen Öl der Blätter der Wasserminze, in einigen Algen sowie im Knochenöl und in Holzdestillaten vor. Es ist ein biogenes Amin und wurde beim Menschen und Tier in kleineren Mengen im Urin nachgewiesen.[8] Außerdem geht man davon aus, dass es Bestandteil der Uratmosphäre war. Daher kann man Spuren von Methylamin auch im All finden.[3]
Gewinnung und Darstellung
Zur großtechnischen Synthese von Methylamin setzt man Methanol mit Ammoniak bei Temperaturen von 350–450 °C und Drücken von 15–25 bar in Gegenwart von Aluminiumoxid (-silicat oder -phosphat) in Rohrreaktoren um.[9][10]
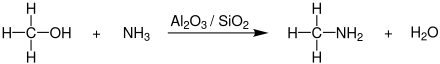
Als Nebenprodukte werden neben Wasser auch noch Dimethylamin und Trimethylamin gebildet, die durch mehrstufige Druck- sowie Extraktivdestillation abgetrennt werden müssen. Das Gewichtsverhältnis von Mono-, Di- und Trimethylamin bei dieser Reaktion beträgt durchschnittlich ca. 20:20:60.[9]
Die Produktionskapazität für Methylamin betrug 1996 weltweit ungefähr 830.000 Jahrestonnen.[10]
Weiterhin kann Methylamin durch Umsetzung von Formaldehyd mit Ammoniumchlorid gewonnen werden, wobei man zuerst Methylammoniumchlorid erhält.[11] Für noch kleinere Mengen, z. B. für Experimente im Labormaßstab oder für Schulversuche, wird Methylamin in situ erzeugt, indem man das handelsübliche feste Salz Methylamin-Hydrochlorid alias Methylammoniumchlorid in eine starke Base, z. B. Natronlauge gibt.[12][13]
Eigenschaften
Physikalische Eigenschaften
Methylamin hat eine relative Gasdichte von 1,1 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine Gasdichte unter Normbedingungen (0 °C und 1013 mbar) von 1,4301 kg/m3. Die Dichte der flüssigen Phase am Siedepunkt beträgt 0,6942 kg/l, die Gasdichte bei 15 °C ist mit 1,3283 kg/m3 angegeben. Des Weiteren weist Monomethylamin einen Dampfdruck von 3,00 bar bei 20 °C, 4,20 bar bei 30 °C und 7,8 bar bei 50 °C auf.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend:
im Temperaturbereich von 190 K bis 267 K.[14] Die kritische Temperatur liegt bei 156,9 °C, der kritische Druck bei 74,1 bar und die kritische Dichte bei 0,216 g/cm3.[1]
Chemische Eigenschaften
Methylamin ist ein extrem leicht entzündbares Gas aus der Stoffgruppe der primären Amine. Methylamin-Luft-Gemische sind deshalb explosiv.[1][3]
Die wässrigen Lösungen reagieren stark alkalisch. Bei 20 °C lösen sich 1080 g/l in Wasser. Eine wässrige Lösung von Methylamin bei 20 °C und einer Konzentration von 100 g/l weist einen pH-Wert von 14 auf. Mit Säuren reagiert es zu kristallisierenden, wasserlöslichen Methylammonium-Salzen.
Verwendung
Methylamin ist ein wichtiges Zwischenprodukt der chemischen und weiterverarbeitenden Industrie. Es wird zur Synthese von Pharmazeutika (z. B Desoxyn, Theophyllin) und Pestiziden (z. B Carbaryl, Metam-Natrium, Carbofuran) eingesetzt. Ein großer Teil wird auch zu N-Methyl-2-pyrrolidon (NMP), einem bedeutenden organischen Lösungsmittel weiterverarbeitet. Außerdem ist es Ausgangsstoff für Guanidine, Amide, Imine, Aminoalkohole, Diamine, modifizierte Aminosäuren und α-Aminophosphonate. Des Weiteren dient es zur Synthese von Metallkomplexen und zur Modifikation von Polymeren. Außerdem wird Methylamin auch zu N,N′-Dimethylharnstoff umgesetzt, welcher wiederum zur Synthese von Coffein, Arzneistoffen oder Herbiziden eingesetzt wird. In der organischen Synthese wird Monomethylamin auch zur Einführung einer Methylamino-Gruppe in andere Moleküle eingesetzt.[3]
Sicherheitshinweise
Gasförmiges Monomethylamin wird hauptsächlich über den Atemtrakt aufgenommen. Bei Kontakt mit wässrigen Lösungen kann es auch zu einer Hautresorption kommen. Bei Aufnahme oder Inhalation kann es zu starken Reizungen der Schleimhäute, insbesondere im Atemtrakt und den Augen, kommen. Diese können schnell zu Verätzungen führen. Durch unterkühltes, flüssiges MMA kann es ebenfalls zu Vereisungen und Verätzungen der Haut kommen. Bei längerer Exposition zeigte sich zudem eine Störung des Allgemeinbefindens. Außerdem bildet Methylamin mit Luft explosive Gemische. Bei hoher Konzentration besteht Erstickungsgefahr. Der Stoff wird zudem als gewässergefährdend eingestuft. Methylamin weist eine untere Explosionsgrenze von 4,99 Vol.-% bei 60 g/cm3 und eine obere Explosionsgrenze von 20,7 Vol.-% bei 270 g/cm3 auf. Die Zündtemperatur beträgt 430 °C. Der Stoff fällt somit in die Temperaturklasse T2 und in die Explosionsklasse IIA. Mit einem Flammpunkt von −30 °C gilt Methylamin als extrem leicht entflammbar. Der Flammpunkt einer 40%igen wässrigen Lösung beträgt −18 °C.[1]
Einzelnachweise
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
l m n
o p q
r Eintrag zu
 Methylamin in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Methylamin in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-94.
- ↑ Hochspringen nach: a b c d Eintrag zu Methylamin. In: Römpp Online. Georg Thieme Verlag.
- ↑ Eintrag zu
 Methylamine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Methylamine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 74-89-5 bzw. Methylamin).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 74-89-5 bzw. Methylamin).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Heinrich Debus: Ueber die
Darstellung des Methylamins aus Blausäure und Wasserstoff. In: Liebigs Annalen der Chemie.
Band 128, 1863,
S. 200
(
 hathitrust.org.)
hathitrust.org.)
- ↑ Andrew A. Ormsby, Shirley Johnson: A COLORIMETRIC METHOD FOR THE DETERMINATION
OF METHYLAMINE IN URINE. In: Journal of Biological Chemistry.
Band 187,
Nr. 2, Dezember 1950,
S. 711–717,
doi:
 10.1016/S0021-9258(18)56217-7
(
10.1016/S0021-9258(18)56217-7
(  elsevier.com).
elsevier.com).
- ↑ Hochspringen nach: a b Patent
 EP1931466B1:
Formkörper enthaltend ein Alumosilikat und Aluminiumoxid und Verfahren zur kontinuierlichen Herstellung von Methylaminen. Veröffentlicht am
14. November 2012, Anmelder: BASF SE, Erfinder: Marco Bosch, Roderich Röttger, Jan Eberhardt, Thomas Krug, Theodor Weber,
Karl-Heinz Ross, Manfred Julius.
EP1931466B1:
Formkörper enthaltend ein Alumosilikat und Aluminiumoxid und Verfahren zur kontinuierlichen Herstellung von Methylaminen. Veröffentlicht am
14. November 2012, Anmelder: BASF SE, Erfinder: Marco Bosch, Roderich Röttger, Jan Eberhardt, Thomas Krug, Theodor Weber,
Karl-Heinz Ross, Manfred Julius.
- ↑ Hochspringen nach: a b Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 55.
- ↑ C. S. Marvel, R. L. Jenkins:
 Methylamine Hydrochloride In: Organic Syntheses. 3, 1923, S. 67,
doi:
Methylamine Hydrochloride In: Organic Syntheses. 3, 1923, S. 67,
doi:  10.15227/orgsyn.003.0067; Coll. Vol. 1, 1941,
S. 347 (
10.15227/orgsyn.003.0067; Coll. Vol. 1, 1941,
S. 347 (  PDF).
PDF).
- ↑ Klaus Ruppersberg, Stefanie Herzog, Manfred W. Kussler, Ilka Parchmann: How to
visualize the different lactose content of dairy products by Fearon’s test and Woehlk test in classroom experiments and a new approach to the mechanisms and formulae of the
mysterious red dyes. In: Chemistry Teacher International.
Band 2,
Nr. 2. De Gruyter, Berlin 17. Oktober 2019,
doi:
 10.1515/cti-2019-0008.
10.1515/cti-2019-0008.
- ↑ W. R. Fearon: The detection of lactose and maltose by means of methylamine.
In: The Analyst. Band 67,
Nr. 793, 1942,
S. 130,
doi:
 10.1039/an9426700130.
10.1039/an9426700130.
- ↑ J. G. Aston, C. W. Stiller, G. H. Messerly: Heat
capacities and entropies of organic compounds. III. Methylamine from 12K to the boiling point. Heat of vaporization and vapor pressure. The entropy from molecular data.
In: Journal of the American Chemical Society.
Band 59,
Nr. 9, 1937,
S. 1743–1751,
doi:
 10.1021/ja01288a054 (englisch).
10.1021/ja01288a054 (englisch).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.02. 2026



