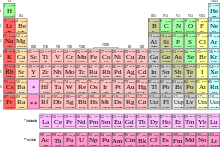
Das Periodensystem der Elemente
Nach der Kernladungszahl (Ordnungszahl) und der
Elektronenkonfiguration ihrer
Atome ordnet man
die Elemente in Gruppen und Perioden an.
Dieses System wurde vom russischen Gelehrten Dmitri Iwanowitsch Mendelejew
fast zeitgleich mit dem deutschen Arzt und
Chemiker Lothar Meyer 1869
begründet. vergleiche: Geschichte
Historisch war das Periodensystem für die Vorhersage der Entdeckung neuer Elemente und deren Eigenschaften von besonderer Bedeutung.
Heute dient es vor allem der Übersicht.
Das Element 82 (Blei) ist das letzte Element, von dem stabile, also nicht radioaktive Isotope existieren. Alle nachfolgenden (Ordnungszahl 83 und höher) sind ausnahmslos radioaktiv und somit instabil. Dabei ist 83 (Bismut) ein Sonderfall oder Grenzfall mit einer extrem langen Halbwertszeit. Auch innerhalb der Elemente 1 bis 82 sind zwei Stoffe enthalten, die radioaktiv, also instabil sind: 43 (Technetium) und 61 (Promethium).
So bleiben tatsächlich nur 80 stabile Elemente übrig, die in der Natur vorkommen – alle anderen sind radioaktive Elemente. Von den radioaktiven Elementen sind nur Bismut, Thorium und Uran in größeren Mengen in der Natur vorhanden, da diese Elemente Halbwertszeiten in der Größenordnung des Alters der Erde oder länger haben. Alle anderen radioaktiven Elemente sind bis auf ein Isotop des Plutoniums entweder wie das Radium intermediäre Zerfallsprodukte einer der drei natürlichen radioaktiven Zerfallsreihen oder entstehen bei seltenen natürlichen Kernreaktionen oder durch Spontanspaltung von Uran und Thorium. Elemente mit Ordnungszahlen über 94 können nur künstlich hergestellt werden; obwohl sie ebenfalls bei der Elementsynthese in einer Supernova entstehen, wurden aufgrund ihrer kurzen Halbwertszeiten bis heute noch keine Spuren von ihnen in der Natur gefunden.
Die Kurzbezeichnung oder Abkürzung wird vom meist lateinischen Namen des Elements (Pb von plumbum, Fe von ferrum usw.) abgeleitet.
Identifiziert werden chemische Elemente über Nachweisreaktionen der Analytischen Chemie; ihre Entstehung und Verteilung im Universum beschreibt die Kosmochemie.
Die internationale Chemie-Union (Iupac) hat vier neue Elemente offiziell ins Periodensystem aufgenommen - und ihre Namen sind jetzt auch vergeben.
| Element | Ordnungszahl | stabilstes Isotop | Halbwertszeit (ms) | ||||||||||||||||||||||||||||||||
| Nihonium | 113 | 284Nh | 480 | ||||||||||||||||||||||||||||||||
| Moscovium | 115 | 289Mc | 320 | ||||||||||||||||||||||||||||||||
| Tennessine | 117 | 294Ts | 78 | ||||||||||||||||||||||||||||||||
| Oganesson | 118 | 294Og* | 0,89 | ||||||||||||||||||||||||||||||||
| *bisher nur ein Isotop erzeugt | |||||||||||||||||||||||||||||||||||
| Auffüllen der Schale | |||||||||||||||||||||||||||||||||||
| 1 | H | He | K (n = 1) | ||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | L (n = 2) | ||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | M (n = 3) | ||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | N (n = 4) | ||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | O (n = 5) | ||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | P (n = 6) | ||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Q (n = 7) | ||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Serie: | Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | |
| Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Chemie unbekannt |
Geschichte
Die Datierung der Entdeckung solcher chemischen Elemente, die bereits seit der Frühzeit oder Antike bekannt sind, ist nur ungenau und kann je nach Literaturquelle um mehrere Jahrhunderte schwanken. Sicherere Datierungen sind erst ab dem 18. Jahrhundert möglich. Bis dahin waren erst 15 Elemente als solche bekannt und beschrieben (Eisen, Kupfer, Blei, Bismut, Arsen, Zink, Zinn, Antimon, Platin, Silber, Quecksilber, Kohlenstoff, Schwefel und Phosphor).
Bis etwa 1865 war es gelungen eine Klassifizierung und systematisierung der anorganischen und organischen Verbindungen gelungen. Chemisch analoge Verbindungen waren zu Gruppen und Untergruppen zusammengefasst; es wurde möglich, typische Gruppeneigenschaften auf einen typischen chemischen Aufbau zurückzuführen und mit den neuen Struckturformeln widerzuspiegeln.
Eine Klassifizierung der chemischen Elemente, von denen inzwischen 60 bekannt waren, stand noch aus. Es galt nach einer Klassifizierung und Systematisierung zu suchen. Als ein solches Merkmal wurden die Atomgewichte angesehen.
Schon 1816 stellte Johann Wolfgang Döbereiner erstmals einen Zusammenhang
zwischen der Atommasse und
den chemischen Eigenschaften einzelner Elemente fest. 1826 veröffentlichte er die Entdeckung
seiner "Triaden". 1863 stellte John Alexander Reina Newlands eine nach Atommassen geordnete Tabelle der Elemente in Achtergruppen
(Gesetz der Oktaven) auf. Das Periodensystem selbst wurde 1869 nahezu
gleichzeitig und unabhängig voneinander von
Dmitri Iwanowitsch Mendelejew (1834 - 1907) und
Lothar Meyer
(1830 - 1895) aufgestellt. Dabei ordneten sie ebenfalls die chemischen Elemente nach steigenden Atommassen, wobei sie Elemente mit ähnlichen Eigenschaften
untereinander anordneten. Die Entdeckung des Periodensystems der Elemente stellt einen der wichtigsten Schritte auf dem Weg zur Systematisierung und dem Erkennen der
Abhängikeit ihrer Charakteristika vom Atomgewicht dar.
Im Gegensatz zu ihren Vorgängern hatten beide Lücken für neue Elemente gelassen.
Im 20. Jahrhundert wurde der Aufbau der Atome entdeckt, die Periodizität wurde durch den Aufbau der
Elektronenhülle erklärt.
Die Entdeckung des Periodensystems der Elemente stellte einen der wichtigsten Schritte auf dem Weg zur Systematisierung der Elemente und zum Verständnis der Abhängigkeit ihres spezifischen Charakters vom Atomgewicht (und damit vom Atomaufbau) da, auch wenn die der Aufbau der Atome zu dieser Zeit noch nicht explizit entdeckt war, und die Atome von den meisten Naturforschern noch als unteilbares Ganzes angesehen wurden.
Darstellung
Es gibt verschiedene Varianten von Periodensystemen. Die bekannteste Darstellung ordnet die Elemente unter Berücksichtigung der Periodizitäten in einem zweidimensionalen tabellarischen Gitterraster an, in dem jedem Element ein Gitterkästchen entspricht. Die waagerechten Zeilen der Darstellung werden als Perioden bezeichnet, die senkrechten Spalten als Gruppen.
Innerhalb jeder Periode nimmt die Ordnungszahl der Elemente von links nach rechts zu. Die Zeilenumbrüche sind so gewählt, dass chemisch ähnliche Elemente jeweils in derselben Spalte (Gruppe) stehen. Die Elemente einer Gruppe weisen also ähnliches chemisches Verhalten auf. So gibt es etwa die Gruppe der chemisch trägen Edelgase oder die Gruppe der reaktionsfreudigen Halogene.
Die Perioden weisen unterschiedliche Längen auf. Die erste Periode umfasst nur 2 Elemente. Es folgen zwei Perioden mit je 8 Elementen, zwei weitere Perioden mit je 18 Elementen und schließlich zwei Perioden mit je 32 Elementen.
Die Langform des Periodensystems, in der die beiden letzten Perioden als durchgehende Zeilen dargestellt werden, ist wegen der benötigten Breite der Darstellung oft ungünstig. In der meistens benutzten mittellangen Form sind aus diesen Perioden herausgeschnittene Elementgruppen platzsparend unterhalb des Hauptsystems dargestellt. In dieser Form besitzt das Periodensystem 7 Perioden und 18 Gruppen. Es gibt auch eine noch kompaktere, aber heutzutage nur selten verwendete Kurzform des Periodensystems.

© biancahoegel.de;
Datum der letzten Änderung : Jena, den: 10.01. 2026