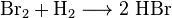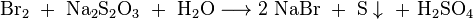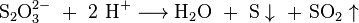Brom
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 0,1 ml/m3 bzw. 0,7 mg/m3 | ||||||||
| Toxikologische Daten | |||||||||
Brom [broːm] (griech. βρῶμος brômos ‚Gestank‘) ist ein chemisches Element mit dem Elementsymbol Br und der Ordnungszahl 35. Im Periodensystem steht es in der 7. Hauptgruppe und gehört damit zusammen mit Fluor, Chlor, Iod, Astat und Ununseptium zu den Halogenen. Elementares Brom liegt unter Normbedingungen (Temperatur = 0 °C und Druck = 1 atm) in Form des zweiatomigen Moleküls Br2 in flüssiger Form vor. Brom und Quecksilber sind die einzigen bekannten Elemente, die unter Normbedingungenflüssig sind.
In der Natur kommt Brom nicht elementar, sondern nur in verschiedenen Verbindungen vor. Die wichtigsten Verbindungen sind die Bromide, in denen Brom in Form des Anions Br− auftritt. Die bekanntesten Bromide sind Natriumbromid und Kaliumbromid. Bromide sind ein Bestandteil des Meerwassers und besitzen einige biologische Funktionen.
Entdeckung

Brom wurde 1826 durch den französischen Chemiker Antoine-Jérôme Balard aus Meeresalgen der Salzwiesen bei Montpellier gewonnen und von diesem als bisher unbekannter Stoff erkannt.
Bereits zwei Jahre vor Balard stellte der deutsche Chemiker Justus von Liebig 1824 unbewusst elementares Brom her. Er hatte den Auftrag, die Salzsolen von Salzhausen zu analysieren, da die Stadt ein Kurbad plante. Bei der Untersuchung dieser Sole fand Liebig eine neue Substanz, die er als Iodchlorid deutete. 13 Jahre später gab er zu, dass ihn seine nachlässige Analyse um die Entdeckung eines neuen Elements gebracht habe. Liebig schrieb dazu: "Ich kenne einen Chemiker, der, als er in Kreuznach war, die Mutterlaugen der Saline untersuchte." Im weiteren beschrieb er dann sein Missgeschick und schloss mit den Worten: "Seit dieser Zeit hat er keine Theorien mehr aufgestellt, wenn sie nicht durch unzweifelhafte Experimente unterstützt und bestätigt wurden; und ich kann vermelden, dass er daran nicht schlecht getan hat."
Eine industrielle Produktion erfolgte ab 1860. Aufgrund seines stechenden Geruchs schlug Joseph Louis Gay-Lussac den Namen "Brom" (griech. für "Bocksgestank der Tiere") vor.
Vorkommen
Brom kommt in Form von Bromiden, den Salzen der Bromwasserstoffsäure, vor. Mengenmäßig finden sich die größten Vorkommen als gelöste Bromide im Meerwasser. Auch Vorkommen natürlicher Salzlagerstätten (Stein- und Kalisalze) enthalten geringe Anteile an Kaliumbromid und Kaliumbromat.
Gewinnung und Darstellung
Die industrielle Herstellung elementaren Broms erfolgt durch Oxidation von Bromidlösungen mit Chlor.
- Durch Oxidation von Kaliumbromid durch Chlor entstehen Brom und Kaliumchlorid
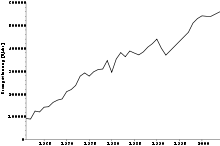
Als Bromidquelle nutzt man überwiegend Sole und stark salzhaltiges Wasser aus großer Tiefe sowie Salzseen, vereinzelt auch Meerwasser. Eine Gewinnung aus den Restlaugen der Kaligewinnung ist nicht mehr wirtschaftlich. Seit 1961 hat sich die jährlich gewonnene Menge an Brom von rund 100.000 Tonnen auf über eine halbe Million Tonnen mehr als verfünffacht. Die größten Brom-Produzenten sind die Vereinigten Staaten, China, Israel, sowie Jordanien.
Im Labor kann Brom durch Umsetzung von Natriumbromid mit Schwefelsäure und Braunstein in der Hitze dargestellt werden. Das Brom wird dabei durch Destillation abgetrennt.
- Aus Natriumbromid, Mangan(IV)-oxid und Schwefelsäure entstehen Brom, Mangan(II)-sulfat und Natriumsulfat
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Brom, Br, 35 |
| Serie | Halogene |
| Gruppe, Periode, Block | 17, 4, p |
| Aussehen | gasförmig: rotbraun flüssig: rotbraun fest: metallisch glänzend |
| CAS-Nummer | 7726-95-6 |
| Massenanteil an der Erdhülle | 6,0 ppm |
| Physikalisch | |
| Aggregatzustand | flüssig |
| Kristallstruktur | orthorhombisch |
| Dichte | 3,12 g / cm3 bei 300 K |
| Magnetismus | diamagnetisch
(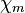 = -2,8 · 10-5)
= -2,8 · 10-5) |
| Schmelzpunkt | 265,8 K (-7,3 °C) |
| Siedepunkt | 331,7 K (58,5 °C) |
| Molares Volumen | (fest) 19,78 · 10-6 m3/mol |
| Verdampfungswärme | 30 kJ/mol |
| Schmelzwärme | 5,8 kJ/mol |
| Dampfdruck | 2,2 · 104 Pa bei 293 K |
| Wärmeleitfähigkeit | 0,12 W/(m · K) |
| Chemisch | |
| Oxidationszustände | ±1, 3, 5, 7 |
| Normalpotential | 1,066 V (Br + e− → Br−) |
| Elektronegativität | 2,96 (Pauling-Skala) |
Eigenschaften

Physikalische Eigenschaften
Die Dichte von Brom beträgt 3,12 g/cm3. Die schwere rotbraune Flüssigkeit bildet chlorähnlich riechende Dämpfe, die giftiger sind als Chlor. Festes Brom ist dunkel, bei weiterer Abkühlung hellt es auf. In Wasser ist es mäßig, in organischen Lösungsmitteln wie Alkoholen, Kohlenstoffdisulfid oder Tetrachlorkohlenstoff sehr gut löslich. In Wasser gelöstes Brom reagiert langsam unter Zwischenbildung von Hypobromiger Säure (HBrO) und Sauerstoffabgabe zu Bromwasserstoff (HBr). Die kinetisch gehemmte Reaktion wird durch (Sonnen-)Licht beschleunigt, Bromwasser wird daher in braunen, wenig lichtdurchlässigen Flaschen aufbewahrt.
Chemische Eigenschaften
Brom verhält sich chemisch wie das leichtere Chlor, reagiert aber im gasförmigen Zustand weniger energisch. Feuchtigkeit erhöht die Reaktivität des Broms stark. Mit Wasserstoff reagiert es im Gegensatz zum Chlor erst bei höheren Temperaturen unter Bildung von Bromwasserstoff (farbloses Gas).
Mit vielen Metallen (z.B. Aluminium) reagiert es exotherm unter Bildung des jeweiligen Bromids. Feuchtem Brom widerstehen nur Tantalund Platin.
Verwendung

- Chemisches Polieren von Galliumarsenid (als Lösung in Methanol);
- mehrfach bromierte Biphenyle bzw. Diphenylether als Flammschutzmittel für Leiterplatten. Im Jahr 2000 wurden 38 % des Broms für die Herstellung von bromierten Flammschutzmitteln verwendet.
- Methylbromid als Schädlingsbekämpfungsmittel;
- Desinfektionsmittel (milder als Chlor);
- in Form von Bromiden, beispielsweise Kaliumbromid, als Arzneimittel (Narkose-, Beruhigungs- und Schlafmittel; Behandlung therapieresistenter Epilepsien mit generalisiert tonisch-klonischen Anfällen, früher sehr beliebt — heute obsolet). 1928 wurde eins von fünf Rezepten in den USA für bromhaltige Medikamente ausgestellt.
- Fotoindustrie (Silberbromid als Bestandteil der lichtempfindlichen Suspension);
- Alkalihypobromite als Bleichmittel;
- im Labor als Indikator (ungesättigte Kohlenstoffverbindungen entfärben Bromwasser, d.h. Addition von Brom);
- Bromate als Oxidationsmittel;
- Bromhaltiger Kautschuk zur Herstellung "luftdichter" Reifen;
- Tränengas, z.B. in Form von Monobromaceton;
- in Mitteln zum Schutz gegen das Nervengas Soman bei US-Soldaten im Irak-Krieg;
- Früher in Form von Alkylbromiden als Scavenger zum Entfernen des Bleis aus Zylindern bei der Nutzung von verbleitem Benzin.
Nachweis
Bromidionen können qualitativ mit Hilfe von Chlorwasser und Hexan nachgewiesen werden.
Zum nasschemischen Nachweis der Bromidionen kann man sich auch wie bei den anderen Nachweisreaktionen für Halogenide die Schwerlöslichkeit des Silbersalzes von Bromid zu Nutze machen. Das Gleiche gilt für die volumetrische Bestimmung der Halogenide durch Titration.
ZurSpurenbestimmung und Speziierung von Bromid und Bromat wird die Ionenchromatografie eingesetzt. In der Polarografie ergibt Bromat eine kathodische Stufe bei -1,78 V (gegen SCE, in 0,1 mol/l KCl), wobei es zum Bromid reduziert wird. Mittels Differenzpulspolarografie können auch Bromatspuren erfasst werden.
Sicherheitshinweise
Elementares Brom ist sehr giftig und stark ätzend, Hautkontakt führt zu schwer heilenden Verätzungen. Inhalierte Bromdämpfe führen zu Atemnot, Lungenentzündung und Lungenödem. Auch auf Wasserorganismen wirkt Brom giftig.
Im Labor wird beim Arbeiten mit Brom meist eine dreiprozentige Natriumthiosulfatlösung bereitgestellt, da sie verschüttetes Brom oder Bromwasserstoff sehr gut binden kann. Hierbei bilden sich Natriumbromid, elementarer Schwefel und Schwefelsäure. Durch die entstehende Säure kann weiteres Thiosulfat zu Schwefel und Schwefeldioxid zerfallen:
Die Aufbewahrung von Brom erfolgt in Behältern aus Glas, Blei, Monel, Nickel oder Teflon.
Verbindungen
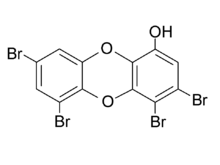
Brom bildet Verbindungen in verschiedenen Oxidationsstufen von -1 bis +7. Die stabilste und häufigste Oxidationsstufe ist dabei -1, die höheren werden nur in Verbindungen mit den elektronegativeren Elementen Sauerstoff, Fluorund Chlor gebildet. Dabei sind die ungeraden Oxidationsstufen +1, +3, +5 und +7 stabiler als die geraden.
Bromwasserstoff und Bromide
Anorganische Verbindungen, in denen das Brom in der Oxidationsstufe -1 und damit als Anion vorliegt, werden Bromide genannt. Diese leiten sich von der gasförmigen Wasserstoffverbindung Bromwasserstoff (HBr) ab. Diese ist eine starke Säure und gibt in wässrigen Lösungen leicht das Proton ab. Bromide sind in der Regel gut wasserlöslich, Ausnahmen sind Silberbromid, Quecksilber(I)-bromid und Blei(II)-bromid.
Besonders bekannt sind die Bromide der Alkalimetalle, vor allem das Natriumbromid. Auch Kaliumbromid wird in großen Mengen, vor allem als Dünger und zur Gewinnung anderer Kaliumverbindungen, verwendet.
Bromoxide
Es ist eine größere Anzahl Verbindungen von Brom und Sauerstoffbekannt. Diese sind nach den allgemeinen Formeln BrOx (x = 1–4) und Br2Ox (x = 1–7) aufgebaut. Zwei der Bromoxide, >Dibromtrioxid (Br2O3) und Dibrompentaoxid (Br2O5) lassen sich als Feststoff isolieren.
Bromsauerstoffsäuren
Neben den Bromoxiden bilden Brom und Sauerstoff auch mehrere Säuren, bei denen ein Bromatom von einem bis vier Sauerstoffatomen umgeben ist. Dies sind die Hypobromige Säure, die Bromige Säure, die Bromsäure und die Perbromsäure. Sie sind als Reinstoff instabil und nur in wässriger Lösung oder in Form ihrer Salze bekannt.
Interhalogenverbindungen
Brom bildet vorwiegend mit Fluor, zum Teil auch mit den anderen Halogenen eine Reihe von Interhalogenverbindungen. Bromfluoride wie Bromfluorid und Bromtrifluorid wirken stark oxidierend und fluoriend. Während Brom in den Fluor-Brom- und Chlor-Brom-Verbindungen als elektropositiveres Element in Oxidationsstufen +1 im Bromchlorid bis +5 im Brompentafluorid vorliegt, ist es in Verbindungen mit Iod der elektronegativere Bestandteil. Mit diesem Element sind die Verbindungen Iodbromid und Iodtribromid bekannt.
Organische Bromverbindungen
Eine Vielzahl von organischen Bromverbindungen (auch Organobromverbindungen) wird synthetisch hergestellt. Wichtig sind die Bromalkane, die Bromalkene sowie dieBromaromaten. Eingesetzt werden sie unter anderem als Lösungsmittel, Kältemittel, Hydrauliköle, Pflanzenschutzmittel, Flammschutzmittel oder Arzneistoffe.
Zu den Organobromverbindungen gehören auch die polybromierten Dibenzodioodtribromid bekannt.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 14.07. 2025