
Exotherme Reaktion
Eine chemische Reaktion ist exotherm, wenn sie mehr Energie freisetzt, als ihr zunächst als Aktivierungsenergie zugeführt wurde. (Die Bezeichnung kommt von griechisch ἔξω exo ‚außen‘ und θερμός thermós ‚warm‘, ‚heiß‘, ‚hitzig‘).
Die Produkte
einer exothermen Reaktion haben eine geringere Enthalpie
als die Ausgangsstoffe; die Reaktionsenthalpie
einer exothermen Reaktion ist also negativ.
Findet die Reaktion bei konstantem Druck statt (also unter isobaren Bedingungen), ist die Enthalpieabnahme zahlenmäßig gleich der abgegebenen Wärmemenge (siehe → Enthalpie für eine nähere Erläuterung). Im isobaren Fall sind die exothermen Reaktionen also gerade diejenigen, bei denen Wärme an die Umgebung abgegeben wird.
Gelegentlich werden exotherme Reaktionen auch pauschal definiert als Reaktionen, die Wärme abgeben. Im isobaren Fall sind beide Definitionen identisch, darüber hinaus aber im Allgemeinen nicht. Findet die Reaktion beispielsweise bei konstant gehaltenem Volumen statt, entspricht die abgegebene Wärmemenge der Änderung der inneren Energie des Systems, nicht der Änderung der Enthalpie (siehe → Enthalpie für eine nähere Erläuterung). Dieser Artikel verwendet im Folgenden die eingangs benutzte Definition als Reaktion mit negativer Reaktionsenthalpie. Diese Definition hat den Vorteil, dass die Enthalpie eine Zustandsgröße ist, die Kenntnis von Anfangs- und Endzustand also ausreicht, um die Enthalpieänderung zu ermitteln. Die abgegebene Wärme hingegen ist eine Prozessgröße und es ist im Allgemeinen notwendig, auch Details über den Prozessverlauf zu wissen, um sie berechnen zu können.
Den Gegensatz zur exothermen Reaktion bildet die endotherme Reaktion, deren Reaktionsenthalpie positiv ist und die im isobaren Fall die der Enthalpiezunahme zahlenmäßig entsprechende Wärmemenge aufnimmt. Ist eine betrachtete Reaktion exotherm, dann ist die Umkehrreaktion endotherm, und umgekehrt.
Falls die Reaktion in einem adiabatischen Behälter stattfindet, so dass keine Wärme mit der Umgebung ausgetauscht werden kann, führt eine exotherme Reaktion zu einer Erhöhung der Temperatur und eine endotherme Reaktion zu einer Erniedrigung der Temperatur.
In der Physik bezeichnet man eine Kernreaktion, bei der Energie frei wird, als exotherm. Eine exotherme Kernfusion ist etwa das Wasserstoffbrennen, wie es in der Sonne geschieht. Ebenfalls stark exotherm ist die Kernspaltung von beispielsweise Uran.
Beispiele
Typische exotherme Reaktionen sind:
- Feuer (Verbrennung)
- Abbinden (= Aushärten) von Beton.
- Nach kurzzeitigem erhitzen reagieren Eisen und Schwefel unter Licht- und Wärmeentwicklung zu Eisensulfid
Exotherm, wenn auch in weit geringerem Maße, verläuft oft auch das Mischen von Stoffen (Mischungswärme) oder die Adsorption und Absorption von Stoffen etwa an Aktivkohle oder Zeolithen.
Exotherme und exergone Reaktionen

Es erscheint zunächst naheliegend anzunehmen, dass die exothermen Reaktionen
gerade diejenigen Reaktionen seien, die freiwillig ablaufen, und dass sie umso
heftiger abliefen, je mehr Wärme freigesetzt wird. In vielen Fällen verhalten
sich die chemischen Reaktionen auch tatsächlich so. Diese Erfahrung führte in
den Anfangsjahren der Thermochemie
zur Formulierung des Prinzips von Thomsen
und Berthelot.
Diese empirische – aber nicht strikt gültige – Regel besagt: Werden Reaktanten unter isobaren und
isothermen
Bedingungen zusammengebracht, so dass eine chemische Reaktion ablaufen kann,
dann ist der resultierende neue Gleichgewichtszustand dadurch gekennzeichnet,
dass der zu ihm führende Prozess mehr Wärme freisetzt als jeder andere mögliche
Prozess. Mit anderen Worten: Von allen möglichen Prozessen wird der am stärksten
exotherme realisiert. Das Prinzip ist auch gleichbedeutend mit der Aussage, dass
der realisierte Prozess den Enthalpieunterschied
möglichst groß und damit die resultierende Enthalpie
möglichst klein macht.
Die Existenz freiwillig ablaufender endothermer Reaktionen (beispielsweise einer verdunstenden Flüssigkeit) zeigt freilich, dass dieses Prinzip keine Allgemeingültigkeit beanspruchen kann. Das tatsächliche Kriterium ist: Es laufen genau jene Reaktionen freiwillig ab, die zu einer Zunahme der Gesamtentropie des Systems und seiner Umgebung führen. Unter isobaren und isothermen Bedingungen ist dieses Kriterium der Gesamtentropie-Maximierung gleichbedeutend mit der Minimierung der Gibbs-Energie des Systems. Eine Reaktion, welche die Gibbs-Energie des Systems verringert, heißt exergone Reaktion. Die Unterscheidung zwischen freiwillig und nicht freiwillig ablaufenden Reaktionen ist gleichbedeutend mit der Unterscheidung zwischen exergonen und endergonen Reaktionen.
Ein Beispiel für eine zwar endotherme, aber trotzdem freiwillig ablaufende chemische Reaktion ist der Zerfall von Distickstofftrioxid in Stickstoffmonoxid und Stickstoffdioxid:
Die Reaktionsenthalpie
dieses Zerfalls ist positiv, die Reaktion also endotherm. Die Gibbssche
Reaktionsenergie
ist jedoch negativ, die Reaktion also exergon.
Die Änderung der Gibbs-Energie
beträgt unter isothermen Bedingungen
.
Bei kleinen Temperaturen ist
und die Minimierung der Gibbs-Energie
ist näherungsweise gleichbedeutend mit der Minimierung der Enthalpie
des Systems. In diesem Fall sind die exergonen Reaktionen meist auch exotherme
Reaktionen, und das Prinzip von Thomsen und Berthelot sagt die
Gleichgewichtszustände mittels Betrachtung der Enthalpieänderung näherungsweise
korrekt voraus. Auch bei höheren Temperaturen (wie etwa Raumtemperatur) bleibt
das Prinzip näherungsweise korrekt, da die Temperaturabhängigkeiten von
und
bei nicht zu hohen Temperaturen ähnlich sind (wie sich unter Berücksichtigung
des Dritten
Hauptsatzes zeigen lässt)
und die Ähnlichkeit von
und
daher bei Temperaturzunahme auch über einen größeren Temperaturbereich erhalten
bleibt.
Wenn allerdings eine Reaktion mit einer hinreichend großen Entropiezunahme
einhergeht (wie in den genannten Fällen der verdunstenden Flüssigkeit oder des
Zerfalls von Distickstofftrioxid), dann kann es vorkommen, dass der Term
überwiegt und die Reaktion freiwillig abläuft (exergon,
),
obwohl ihre Enthalpie dabei zunimmt (endotherm,
),
die Reaktion hinsichtlich der Enthalpie also „bergauf läuft“.
Ablauf
Auch wenn eine Reaktion exergon ist, also aus energetischer Sicht freiwillig abläuft, ist damit noch nicht sichergestellt, dass sie auch ohne äußeren Anstoß selbstständig abzulaufen beginnt. Ein Beispiel dafür ist die Reaktion von Kohlenstoff mit Sauerstoff zu Kohlenstoffdioxid:
Diese Verbrennungsreaktion
ist exergon ().
Ein Stück Kohle gerät jedoch nicht beim bloßen Kontakt mit dem Sauerstoff der
Luft in Brand; es muss erst entzündet werden. Anschließend läuft die Verbrennung
selbstständig weiter.
In solchen Fällen liegen die Reaktanten ursprünglich nicht in einem
reaktionsfähigen Zustand vor. Oft müssen erst Bindungen
aufgebrochen werden, bevor sie in neuer Anordnung wieder gebildet werden können
– in diesem Fall die des -Moleküls.
In der Regel geschieht dies bei der Kollision zweier beteiligter Atome oder
Moleküle. Bei der Wechselwirkung während der Kollision werden die ursprünglichen
Bindungen zunächst gedehnt, wozu Energie aufgewendet werden muss.
Die kollidierenden Teilchen liegen kurzzeitig als so genannter aktivierter
Komplex vor, dessen Enthalpieinhalt größer ist als jener der einzelnen
Teilchen zusammengenommen; die Enthalpie stammt in der Regel aus der
Wärmebewegung der Teilchen. Verfügt der aktivierte Komplex über hinreichend viel
Enthalpie, um die betreffenden Bindungen vollends aufzubrechen (die so genannte
Aktivierungsenthalpie), dann kann die Reaktion ablaufen. Andernfalls läuft die
Reaktion nicht ab, obwohl sie in thermodynamischer Hinsicht möglich wäre – sie
ist „kinetisch gehemmt“ – und die Reaktanten verbleiben in ihrem metastabilen
Ausgangszustand. Die Reaktion kann in diesem Fall nur in Gang gesetzt werden,
wenn dem System genügend zusätzliche Energie zugeführt wird, meist in Form von
Wärmeenergie.
Im Falle einer exothermen Reaktion kann diese Wärmeenergie aus der Reaktion selbst stammen. Wenn die Reaktion genügend Enthalpie freisetzt, ist sie selbsterhaltend, sobald sie einmal in Gang gesetzt wurde.
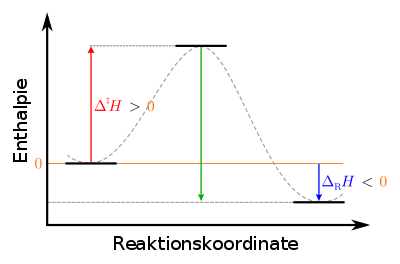 |
Legende: links: Ausgangszustand der Edukte: metastabil mittig: Übergangszustand des aktivierten Komplexes: instabil rechts: Endzustand der Produkte: stabil |
Für die endotherme Umkehrreaktion ist die aufzubringende
Aktivierungsenthalpie größer als für die Hinreaktion, nämlich gerade die Summe
aus Aktivierungsenthalpie
und Reaktionsenthalpie
der Hinreaktion,
wie auch aus dem Diagramm ersichtlich ist.
Kernphysik
Auch bei Kernreaktionen wird der Begriff exotherm benutzt. Er besagt, dass bei der Reaktion Energie freigesetzt wird, die als kinetische Energie der Reaktionsprodukte auftritt. Technisch wichtige exotherme Kernreaktionen sind die neutroneninduzierte Kernspaltung und die Kernfusion von Wasserstoffisotopen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.10. 2023