
Iridium
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Iridium ist ein chemisches Element mit dem Symbol Ir und der Ordnungszahl 77. Es zählt zu den Übergangsmetallen, im Periodensystem steht es in der Gruppe 9 (in der älteren Zählung Teil der 8. Nebengruppe) oder Cobaltgruppe. Das sehr schwere, harte, spröde, silber-weiß glänzende Edelmetall aus der Gruppe der Platinmetalle gilt als das korrosionsbeständigste Element. Unter 0,11 Kelvin wechselt es in den supraleitfähigen Zustand über.
Geschichte
Iridium (griech. ίριοειδής „regenbogenfarbig“ nach der Vielfarbigkeit seiner Verbindungen) wurde 1804 in London von Smithson Tennant zusammen mit Osmium entdeckt. Beim Auflösen von Rohplatin in Königswasser befanden sich beide Platinmetalle im unlöslichen schwarzen Rückstand. Die Farbvielfalt der Iridiumsalze inspirierte Tennant zu dem Namen Iridium. Auch das „Urkilogramm“ sowie das „Urmeter“ bestehen aus einer Iridiumlegierung; beide werden seit 1898 in Paris im Bureau International des Poids et Mesures aufbewahrt.
Vorkommen
Iridium ist seltener als Gold oder Platin. Es ist nach Rhenium zusammen mit Rhodium und Ruthenium das seltenste nicht-radioaktive Metall. Sein Anteil in der kontinentalen Erdkruste beträgt nur 1 ppb. In der Natur tritt es elementar in Form von kleinen Körnern oder in Begleitung des Platins auf. Mit Osmium bildet es zwei natürlich vorkommende Minerale:
- Osmiridium, das zu 50 % aus Iridium, der Rest aus Osmium, Platin, Ruthenium und Rhodium besteht, und
- Iridosmium, das sich zu 55–80 % aus Osmium und zu 20–45 % aus Iridium zusammensetzt.
Wichtige Vorkommen liegen in Südafrika, im Ural, Nord- und Südamerika, in Tasmanien, Borneo und Japan.
Freies Iridium ebenso wie andere Elemente der Platingruppe finden sich in Flusssanden. Daneben fällt Iridium bei der Verhüttung von Nickelerzen an.
Eigenschaften


Physikalische Eigenschaften
Wegen seiner Härte und Sprödigkeit kann Iridium nur schwer bearbeitet werden. Bei Rotglut oxidiert es unvollständig zu schwarzem IrO2, das oberhalb 1140 °C wieder zerfällt. Auch ist Iridium wie Osmium in der Hitze und vor allem bei höherem Sauerstoffgehalt als Oxid IrO3 flüchtig. An kalten Stellen jedoch scheidet es sich im Gegensatz zum Osmium als Metall oder IrO2 wieder ab.
In der natürlich auftretenden Isotopenzusammensetzung ist Iridium nach Osmium das zweitdichteste Element. Das stabile Iridiumisotop 193Ir hat jedoch mit 22,65 g/cm3 die höchste Dichte aller nicht radioaktiven Isotope. Ob Iridium oder Osmium das dichteste Element darstellt, ist also Definitionssache. In der angelsächsischen Literatur gilt überwiegend Osmium als das dichteste Element.
Chemische Eigenschaften
In Mineralsäuren, auch in Königswasser, ist es beständig. In Chlorid-Schmelzen wird es jedoch bei Gegenwart von Chlor zu Doppelchloriden umgesetzt, z.B. Na2[IrCl6].
Isotope
Es gibt zwei natürliche Isotope von Iridium, 34 Radioisotope und 21 Kernisomere, wovon das Kernisomer 192m2Ir mit einer Halbwertszeit von 241 Jahren das stabilste ist. Es zerfällt durch innere Konversion zu 192Ir das mit 73,831 Tagen Halbwertszeit das Isotop mit der längsten HWZ ist.192Ir zerfällt als Betastrahler zum Platinisotop 192mPt, die meisten anderen zu Osmium. Die restlichen Isotope und Kernisomere haben Halbwertszeiten zwischen 300 µs bei 165Ir und 11,78 Tagen bei 190Ir.
192Ir eignet sich wegen seiner Gammastrahlung mit einer Energie von etwa 550 keV (Kiloelektronenvolt) für die Durchstrahlungsprüfung von Bauteilen. Bei Werkstücken mit einer Wanddicke von über 20 mm wird meistens auf dieses Isotop zurückgegriffen (normativ geregelt, siehe z. B. DIN EN 1435).
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Iridium, Ir, 77 |
| Serie | Übergangsmetalle |
| Gruppe, Periode, Block | 9, 6, d |
| Aussehen | silbrig weiß |
| CAS-Nummer | |
| EG-Nummer | 231-095-9 |
| ECHA-InfoCard | |
| Massenanteil an der Erdhülle | 0,001 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Kristallstruktur | kubisch flächenzentriert |
| Dichte | 22,56 g/cm3 |
| Mohshärte | 6,5 |
| Magnetismus | paramagnetisch
(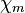 = 3,8 · 10−5)
= 3,8 · 10−5) |
| Schmelzpunkt | 2739 K (2466 °C) |
| Siedepunkt | 4403 K (4130 °C) |
| Molares Volumen | 8,52 · 10−6 m3/mol |
| Verdampfungswärme | 564 kJ/mol |
| Schmelzwärme | 26 kJ/mol |
| Schallgeschwindigkeit | 4825 m/s |
| Elektrische Leitfähigkeit | 19,7 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 150 W/(m · K) |
| Chemisch | |
| Oxidationszustände | −3, −1, 0, 1, 2, 3, 4, 5, 6, 8, 9 |
| Normalpotential | 1,156 V (Ir3+ + 3e− → Ir) |
| Elektronegativität | 2,20 (Pauling-Skala) |
Für die zerstörungsfreie Werkstoffprüfung (ZfP) ist der Iridiumstrahler meistens in Form einer 2–3 mm großen Tablette in einem Strahlerhalter eingeschweißt, und dieser ist in einem verschließbaren Typ-B-Arbeitsbehälter untergebracht, der zur Abschirmung der Gammastrahlung mit abgereichertem Uran ausgekleidet ist.
Arbeitsbehälter für Iridiumstrahler haben folgende Abmessungen: 20 cm lang, 10 cm breit und 15 cm hoch. Das Gewicht beträgt auf Grund des Uranmantels je nach Aktivität etwa 13 bis 20 kg. Damit sind sie für den mobilen Einsatz besser geeignet als industrielle Röntgenanlagen.
Verwendung
Iridium ist oft Bestandteil von Legierungen, denen es Härte und/oder Sprödigkeit verleiht. Platin-Iridium-Legierungen setzt man bei Präzisionsmessungen, in der Medizin und dem Maschinenbau ein.
Weitere Verwendung findet es:
- als Bestandteil der Legierung des Ur-Kilogramms sowie des dritten Ur-Meters,
- zur Umhüllung von Plutoniumdioxid in Isotopenbatterien,
- in Form von Behältern und Tiegeln für Hochtemperaturanwendungen,
- als elektrischer Kontakt,
- in Schmuck als Platin-Iridium-Legierung (PtIr 800 und PtIr 900) für stark beanspruchte Teile (Verschlüsse, Mechaniken und Federn),
- bei Zündkerzen-Elektroden,
- in Schreibfedern für Füllfederhalter wird meist eine Os/Ir-Legierung eingesetzt,
- als Bestandteil von Kugelschreiberminen (Schreibkugel),
- in Legierung mit Platin als Zerstäuberspitze in der Flammen-Atomabsorptionsspektrometrie,
- bei der Messung der Oberflächenspannung nach der Du-Noüy-Ringmethode, wo es in Legierung mit Platin wegen seiner optimalen Benetzbarkeit eingesetzt wird,
- in Sputter-Targets zur Erzeugung von elektronenableitenden Beschichtungen von elektrischen Nichtleitern in der hochauflösenden Rasterelektronenmikroskopie,
- in Form der UV-Schutzschicht auf hochwertigen Sonnenbrillen,
- in Dentallegierungen,
- zunehmend als Katalysator chemischer Reaktionen (industriell wichtiger Einsatz bei der Synthese der Essigsäure),
- wegen seiner hohen Dichte und seines hohen Schmelzpunktes als Target in der Kernphysik, beispielsweise zur Antiprotonenerzeugung im CERN.
- In den Farbstoffen von Organischen Leuchtdioden, zur Erzeugung von Singulett-Triplett-Übergängen
KT-Impakt
Iridium kommt in verhältnismäßig hoher Konzentration in der Sedimentschicht vor, die das Zeitalter der Kreide vom Tertiär trennt, und dient als Indiz für einen großen Meteoriteneinschlag, der unter anderem die Dinosaurier ausgerottet haben soll.
Sicherheitshinweise
Metallisches Iridium ist wegen seiner Beständigkeit ungiftig. Als Pulver oder Staub ist es leicht entzündlich, in kompakter Form nicht brennbar. Iridiumverbindungen müssen als toxisch eingestuft werden.
Verbindungen
Viele Iridiumsalze sind farbig: Mit Chlor bildet es olivgrünes Iridium(III)-chlorid oder dunkelblauschwarzes, nicht ganz definiertes Iridium(IV)-chlorid. Mit Fluor reagiert es zu gelbem, leichtflüchtigem Iridium(VI)-fluorid beziehungsweise gelbgrünem Iridium(V)-fluorid. Die für Iridium bereits vor Jahren vorhergesagte Oxidationsstufe +IX konnte 2014 durch das synthetisierte [IrO4]+ auch experimentell bestätigt werden. Es handelt sich um das einzige Element, bei welchem diese Oxidationsstufe in einer Verbindung bekannt ist.
Einzelnachweise
- ↑ Hochspringen nach: a b Eintrag zu
 Iridium, Pulver in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Iridium, Pulver in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 11.12. 2022

