Erdalkalimetalle
| Gruppe | 2 |
| Periode | |
| 2 | 4 Be |
| 3 | 12 Mg |
| 4 | 20 Ca |
| 5 | 38 Sr |
| 6 | 56 Ba |
| 7 | 88 Ra |
Der Name Erdalkalimetalle bezeichnet die Elemente der 2. Hauptgruppe des Periodensystems. Die Bezeichnung leitet sich von den beiden benachbarten Hauptgruppen, den Alkalimetallen und den Erdmetallen, ab. Ihr gehören die stabilen Elemente Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr) und Barium (Ba) an. Das 6. Element der Gruppe, Radium (Ra), ist ein radioaktives Zwischenprodukt natürlicher Zerfallsreihen.
Eigenschaften

Physikalische Eigenschaften
Mit zunehmender Ordnungszahl wachsen Atommasse, Atomradius und Ionenradius.
Die geringste Dichte hat Calcium mit 1550 kg/m3. Sie steigt nach oben und insbesondere nach unten hin an, wobei Radium mit 5500 kg/m3 den Höchstwert markiert.
Die Mohshärte liegt bei Beryllium mit 5,5 im mittleren Bereich. Die weiteren Elemente der 2. Hauptgruppe weisen geringe Härten auf, die mit steigender Ordnungszahl abnehmen.
Die ersten drei Erdalkalimetalle, insbesondere Beryllium und Calcium, sind sehr gute Elektrizitätsleiter. Obwohl auch die weiteren Elemente dieser Hauptgruppe keinesfalls schlechte Leiter sind, ist der Unterschied beträchtlich.
Die 1. Ionisierungsenergie sinkt mit wachsender Ordnungszahl von 9,322 Elektronenvolt bei Beryllium auf 5,212 eV bei Barium ab. Radium hat mit 5,279 eV wieder einen leicht erhöhten Wert.
Die Elektronegativität fällt von 1,5 bei Beryllium auf 1,0 bei Calcium ab und bleibt bei den weiteren Elementen annähernd auf diesem Niveau.
| Element | Schmelzpunkt (K) | Siedepunkt (K) | Dichte (kg/m3) | Mohshärte | El. Leitfähigkeit (S/m) |
|---|---|---|---|---|---|
| Beryllium | 1551,15 | ~2750 | 1848 | 5,5 | 31,3 · 106 |
| Magnesium | 923 | 1380 | 1738 | 2,5 | 22,6 · 106 |
| Calcium | 1115 | 1757 | 1550 | 1,75 | 29,8 · 106 |
| Strontium | 1050 | 1655 | 2630 | 1,5 | 7,62 · 106 |
| Barium | 1000 | 1913 | 3620 | 1,25 | 3 · 106 |
| Radium | 973 | 2010 | 5500 | 2,3 | 1 · 106 |
Elektronenkonfiguration
Die Elektronenkonfiguration lautet [X] ys2. Das X steht hierbei für die Elektronenkonfiguration des eine Periode höher stehenden Edelgases, und für das y muss die Periode eingesetzt werden, in der sich das Element befindet.
Für die einzelnen Elemente lauten die Elektronenkonfigurationen:
- Beryllium: [ He ] 2s2
- Magnesium: [ Ne ] 3s2
- Calcium: [ Ar ] 4s2
- Strontium: [ Kr ] 5s2
- Barium: [ Xe ] 6s2
- Radium: [ Rn ] 7s2
Der Oxidationszustand ist +2, da die beiden Elektronen in der Außenschale leicht abgegeben werden können. Me2+-Ionen besitzen Edelgaskonfiguration.
Chemische Reaktionen
In den folgenden Gleichungen steht das Me für ein Element aus der zweiten Hauptgruppe (Erdalkalimetalle).
- Reaktion mit Sauerstoff:
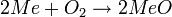
- Barium bildet auch Bariumperoxid (Ba2+(O-O)2-).
- Reaktion mit Wasserstoff:
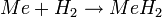
- Die gebildeten Hydride haben eine ionische Struktur.
- Reaktion mit Wasser:
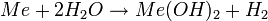
- Reaktion mit Halogenen (am Beispiel Chlor):
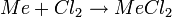
Am Reaktionsverhalten ist die mit der Ordnungszahl ansteigende Reaktivität gut zu beobachten:
- Beständigkeit an Luft:
- Beryllium ist bei Raumtemperatur an trockener Luft beständig, da es von einer passivierenden Oxidschicht überzogen wird.
- Magnesium wird an Luft ebenfalls passiviert, dünne Bänder und Folien lassen sich jedoch leicht entzünden.
- Calcium, Strontium, Barium und Radium laufen an trockener Luft schnell an und sind in fein verteilter Form selbstentzündlich
- Reaktion mit Wasserstoff bei hohen Temperaturen:
- Beryllium reagiert ohne Katalysator nicht mit Wasserstoff.
- Magnesium reagiert nur bei hohem Druck.
- Die weiteren Erdalkalimetalle reagieren bereits bei Atmosphärendruck mit Wasserstoff.
- Reaktion mit Wasser:
- Beryllium wird wie Aluminium in Wasser passiviert.
- Magnesium wird ebenfalls passiviert, die Passivierungsschicht löst sich jedoch in heißem Wasser auf.
- Die übrigen Erdalkalimetalle reagieren bei Raumtemperatur heftig mit Wasser.
Verbindungen

Beryllium bildet als einziges Erdalkalimetall überwiegend kovalente Verbindungen. Die übrigen Elemente der 2. Hauptgruppe kommen fast nur als Me2+-Ionen vor. Die Tabelle stellt eine grobe Übersicht über die wichtigsten Verbindungen dar:
| Beryllium | Magnesium | Calcium | Strontium | Barium | |
|---|---|---|---|---|---|
| Oxide | BeO | MgO | CaO | SrO | BaO |
| Hydroxide | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
| Fluoride | BeF2 | MgF2 | CaF2 | SrF2 | BaF2 |
| Chloride | BeCl2 | MgCl2 | CaCl2 | SrCl2 | BaCl2 |
| Sulfate | BeSO4 | MgSO4 | CaSO4 | SrSO4 | BaSO4 |
| Carbonate | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| Nitrate | Be(NO3)2 | Mg(NO3)2 | Ca(NO3)2 | Sr(NO3)2 | Ba(NO3)2 |
| Sulfide | BeS | MgS | CaS | SrS | BaS |
Sonstige:
- In Zintl-Phasen bilden die zugehörigen Anionen ein bemerkenswertes Gitter.
- Grignard-Verbindungen sind Magnesiumverbindungen der Form R-MgX. R steht dabei für einen organischen Rest und X ist ein Halogen. Sie finden in der organischen Synthese Verwendung.
- Calciumcarbid
(CaC2) bildet ein
Ionengitter mit Ca2+- und (|C≡C|)2--Ionen (NaCl-Struktur). Die
Verbindung wird für drei bedeutende Verfahren benötigt:
- Ethinherstellung durch Hydrolyse:
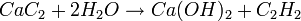
-
- Entschwefelung von Rohstahl
- Azotierung zu Calciumcyanamid
- Calciumoxalat (CaC2O4) ist Hauptbestandteil von Nierensteinen.
- Calciumcyanamid (CaCN2) ist ein Düngemittel, das auch in anderen Bereichen (z.B.: zur Unkraut- und Schädlingsbekämpfung) eingesetzt wird.
- Strontiumtitanat (SrTiO3) wird unter dem Namen Fabulit als Schmuckstein gehandelt.
- Bariumperoxid (Ba2+(O-O)2-) spielte früher bei der Wasserstoffperoxid-Synthese eine wichtige Rolle:
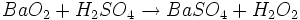
Wasserhärte
Für die Härte des Wassers sind im Wesentlichen gelöste Calcium- und Magnesiumionen verantwortlich. So geht beispielsweise das wasserlösliche Calciumhydrogencarbonat (Ca(HCO3)2) in der Hitze in die schwerlösliche Verbindung Calciumcarbonat (CaCO3) über, die auch als "Kesselstein" bekannt ist:
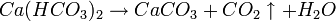
Durch das Entweichen des Kohlendioxids aus der Lösung wird die Rückreaktion verhindert, und der Kesselstein lagert sich in Kochtöpfen etc. ab.
Eine weitere Eigenschaft von Erdalkalimetallionen, jedoch insbesondere von Ca2+ und Mg2+, ist es, mit Seife unlösliche Verbindungen zu bilden. Da Seifen chemisch betrachtet Salze sind, bestehen sie aus Kat- und Anionen. Die Anionen sind stets höhere Fettsäuren, und als Kationen werden meist Alkalimetallionen eingesetzt. Die Erdalkalimetallionen ersetzten diese und bilden so unlösliche Verbindungen, die unter dem Begriff "Kalkseife" zusammengefasst werden.
Vorkommen
Die Erdkruste besteht zu 4,16 % aus Erdalkalimetallen. Diese verteilen sich wie folgt auf die Elemente:
- 67% Calcium
- 31% Magnesium
- 1,4% Barium
- 0,7% Strontium (die Werte sind gerundet, daher ergibt sich eine Summe von etwas mehr als 100%)
- Spuren von Beryllium und noch geringere Mengen Radium
 |
 |
 |
 |
| Dolomit (CaMg(CO3)2) | Kalzit (CaCO3) | Coelestin (SrSO4) | Baryt (BaSO4) |
Die Erdalkalimetalle treten niemals gediegen auf und sind meist als Silikat, Karbonat oder Sulfat gebunden.
Berylliumhaltige Edelsteine
Obwohl Beryllium sehr selten ist, ist es in 30 verschiedenen Mineralien vertreten. Zu den bekanntesten zählen:
 |  |  |  |
| Beryll | Aquamarin | Smaragd | Chrysoberyll |
Nachweis
Der Nachweis der Erdalkalimetalle erfolgt primär spektralanalytisch aufgrund der charakteristischen Spektrallinien. Nasschemische Methoden wie beispielsweise die Ausfällung als Carbonate, Sulfate oder Hydroxide werden mittlerweile nur noch zu Demonstrationszwecken verwendet.
| Ion | Flammenfärbung | Reaktion mit Hydroxid OH- | ...mit Carbonat CO32- | ...mit Sulfat SO42- | ...mit Oxalate C2O42- | ...mit Chromat CrO42- |
|---|---|---|---|---|---|---|
| Beryllium | keine | Be(OH)2 fällt aus | BeCO3 ist löslich | BeSO4 ist löslich | ? | BeCrO4 ist löslich |
| Magnesium | keine | Mg(OH)2 fällt aus | MgCO3 fällt aus | MgSO4 ist löslich | MgC2O4 ist löslich | MgCrO4 ist löslich |
| Calcium | ziegelrot | Ca(OH)2 fällt aus | CaCO3 fällt aus | CaSO4 fällt aus | CaC2O4 fällt aus | CaCrO4 fällt aus |
| Strontium | intensiv rot | Sr(OH)2 fällt aus | SrCO3 fällt aus | SrSO4 fällt aus | SrC2O4 ist löslich | SrCrO4 fällt aus |
| Barium | gelb-grün | Ba(OH)2 ist löslich | BaCO3 fällt aus | BaSO4 fällt aus | BaC2O4 ist löslich | BaCrO4 fällt aus |
| Radium | karminrot | ? | ? | ? | ? | ? |
Sicherheitshinweise
An Luft sind nur Beryllium und Magnesium beständig. Die weiteren Elemente dieser Hauptgruppe müssen unter Paraffinöl oder Inertgas aufbewahrt werden. Die Aufbewahrung unter Alkohol ist nur bei Beryllium, Magnesium und Calcium möglich, da bereits Barium daraus Wasserstoff abspaltet und zum Alkoholat reagiert.
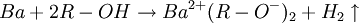
In feinverteilter Form ist Magnesium leichtentzündlich; Calcium-, Strontium- und Bariumpulver können sich an Luft selbst entzünden. Brennende Erdalkalimetalle dürfen keinesfalls mit Wasser gelöscht werden!
Die Erdalkalimetalle sind starke Reduktionsmittel, die sogar in der Lage sind, Alkalimetalle aus Ihren Verbindungen freizusetzen. Diese Reaktionen verlaufen stark exotherm; unter Umständen kann es dabei sogar zu einer Explosion kommen.
Beryllium ist ein Lungengift, wobei der Wirkungsmechanismus noch weitgehend unbekannt ist. Auch seine Verbindungen sind krebserregend.
Bariumverbindungen sind hochgiftig, wenn sie gut wasserlöslich sind. 1 Gramm kann dabei bereits tödlich wirken.
Radium ist aufgrund seiner Radioaktivität äußerst gesundheitsschädlich, doch noch 1928 wurde mit Radium versetztes Wasser unter dem Handelsnamen Radithor zum Trinken verkauft. Die Zahl der Geschädigten oder Umgekommenen ist unbekannt.

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 13.06. 2025
