
Elektron
|
Elektron (e−) | |
|---|---|
| Klassifikation | |
| Elementarteilchen Fermion Lepton | |
| Eigenschaften | |
| Ladung | −1 e (−1,602 176 565(35) · 10−19 C |
| Masse | 5,485 799 0946(22) · 10−4 u 9,109 382 91(40) · 10−31 kg 1 · me 0,510 998 928(11) MeV/c2 |
| Compton-Wellenlänge | 2,426 310 2389(16) · 10−12 m |
| magnetisches Moment | −928,476 430(21) · 10−26 J/ T |
| g-Faktor | −2,002 319 304 361 53(53) |
| gyromagnetisches Verhältnis | 1,760 859 708(39) · 10111/(T) |
| Spin | 1/2 |
| mittlere Lebensdauer | stabil |
| Wechselwirkungen | schwache Wechselwirkung, elektromagnetische Wechselwirkung, Gravitation |
Das Elektron [ˈeːlɛktrɔn, eˈlɛk-, elɛkˈtroːn] (von altgriechisch ἤλεκτρον élektron ‚Bernstein‘, an dem Elektrizität zum ersten Mal beobachtet wurde; 1874 von Stoney und Helmholtz geprägt) ist ein negativ geladenes Elementarteilchen. Sein Symbol ist e−. Die alternative Bezeichnung Negatron wird kaum noch verwendet und ist allenfalls in der Beta-Spektroskopie gebräuchlich.
In Atomen und in Ionenbilden Elektronen die Elektronenhülle. Die gesamte Chemie beruht im Wesentlichen auf den Eigenschaften und Wechselwirkungen dieser gebundenen Elektronen. Der Zustand jedes der gebundenen Elektronen lässt sich dabei eindeutig durch vier Quantenzahlen (Hauptquantenzahl, Nebenquantenzahl, magnetische Quantenzahl des Drehimpulses und Spinquantenzahl) beschreiben (Pauli-Prinzip). Die freie Beweglichkeit einiger der Elektronen in Metallen ist die Ursache für die elektrische Leitfähigkeit von metallischen Leitern. Unabhängig von der Atomhülle wird beim Beta-Minus-Zerfall eines Atomkerns ein Elektron neu erzeugt und ausgesandt.
Der experimentelle Nachweis von Elektronen gelang erstmals im Jahre 1897 durch den Briten Joseph John Thomson.
Geschichte der Entdeckung des Elektrons
Das Konzept einer kleinsten, unteilbaren Menge der elektrischen Ladung wurde um die Mitte des 19. Jahrhunderts verschiedentlich vorgeschlagen, unter anderen von Richard Laming, Wilhelm Weber und Hermann von Helmholtz.
George Johnstone Stoney schlug 1874 die Existenz elektrischer Ladungsträger vor, die mit den Atomen verbunden sein sollten. Ausgehend von der Elektrolyse schätzte er die Größe der Elektronenladung ab, erhielt allerdings einen um etwa den Faktor 20 zu niedrigen Wert. Beim Treffen der British Association in Belfast schlug er vor, die Elementarladung zusammen mit der Gravitationskonstante und Lichtgeschwindigkeit als fundamentale Naturkonstanten als Grundlage physikalischer Maßsysteme zu verwenden. Stoney prägte auch gemeinsam mit Helmholtz den Namen electron für das „Atom der Elektrizität“.
Das Elektron als Elementarteilchen wurde 1897 von Joseph John Thomson nachgewiesen (er bezeichnete es zuerst als corpuscule). Er konnte zeigen, dass die Art der Teilchen in der Kathodenstrahlung unabhängig vom Kathodenmaterial und vom Restgas in der Kathodenstrahlröhre ist. In dieser Zeit wurden auch die im Atom gebundenen Elektronen anhand des Zeeman-Effektes nachgewiesen.
Die Elementarladung wurde 1909 durch Robert Millikan gemessen.
Eigenschaften
Das Elektron ist das leichteste der elektrisch geladenen Elementarteilchen. Wenn die Erhaltungssätze für Ladung und Energie gelten – was aller physikalischen Erfahrung entspricht – müssen Elektronen daher stabil sein. In der Tat gibt es bisher keinerlei experimentellen Hinweis auf einen Elektronenzerfall.
Elektronen gehören zu den Leptonen und haben, wie alle Leptonen, einen Spin von 1/2. Als Teilchen mit halbzahligem Spin gehören sie zur Klasse der Fermionen, unterliegen also insbesondere dem Pauli-Prinzip. Ihre Antiteilchen sind die Positronen, Symbol e+, mit denen sie bis auf ihre elektrische Ladung in allen Eigenschaften übereinstimmen.
Einige der Grundeigenschaften des Elektrons, die in der Tabelle rechts aufgelistet sind, werden durch das magnetische Moment des Elektronenspins miteinander verknüpft:
 .
.
Dabei ist  das
magnetische Moment des Elektronenspins,
das
magnetische Moment des Elektronenspins,  die Massedes Elektrons,
die Massedes Elektrons,  seine Ladung und
seine Ladung und 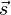 der
Spin.
der
Spin.  heißt Landé- oder g-Faktor.
Der Term vor
heißt Landé- oder g-Faktor.
Der Term vor 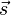 ,
der das Verhältnis aus magnetischem Moment zum Spin beschreibt, wird als
gyromagnetisches Verhältnis des Elektrons bezeichnet.
Für das Elektron ist nach der Dirac-Theorie
(relativistische Quantenmechanik) der theoretische Wert von
,
der das Verhältnis aus magnetischem Moment zum Spin beschreibt, wird als
gyromagnetisches Verhältnis des Elektrons bezeichnet.
Für das Elektron ist nach der Dirac-Theorie
(relativistische Quantenmechanik) der theoretische Wert von  exakt gleich 2. Effekte der Quantenelektrodynamik
bewirken jedoch eine (geringfügige) Abweichung des Wertes für
exakt gleich 2. Effekte der Quantenelektrodynamik
bewirken jedoch eine (geringfügige) Abweichung des Wertes für  von 2. Die dadurch hervorgerufene Abweichung des magnetischen Moments wird als
anomales magnetisches Moment des Elektrons bezeichnet.
von 2. Die dadurch hervorgerufene Abweichung des magnetischen Moments wird als
anomales magnetisches Moment des Elektrons bezeichnet.
Klassischer Radius und Punktförmigkeit
Kurz nach der Entdeckung des Elektrons versuchte man seine Ausdehnung
abzuschätzen, insbesondere wegen der klassischen Vorstellung von kleinen
Billardkugeln, die bei Streuexperimenten aufeinanderstoßen. Die Argumentation
lief darauf hinaus, dass die Konzentration der Elektronenladung auf eine sehr
kleine Ausdehnung des Elektrons Energie benötige, die nach dem Äquivalenzprinzip
in der Masse des Elektrons stecken müsse. Unter der Annahme, dass die Energie
 eines Elektrons in Ruhe gleich der Selbstenergie
eines Elektrons in Ruhe gleich der Selbstenergie
 der
Elektronenladung im eigenen elektrischen Feld sei, erhält man den klassischen
Elektronenradius
der
Elektronenladung im eigenen elektrischen Feld sei, erhält man den klassischen
Elektronenradius
 :
Elementarladung,
:
Elementarladung, 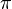 :
Kreiszahl,
:
Kreiszahl, 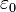 :
Elektrische Feldkonstante,
:
Elektrische Feldkonstante,  :
Elektronenmasse,
:
Elektronenmasse,  :
Lichtgeschwindigkeit,
:
Lichtgeschwindigkeit,
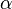 :
Feinstrukturkonstante,
:
Feinstrukturkonstante,
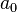 :
Bohrscher Radius.
:
Bohrscher Radius.
Die Selbstenergie trennt dabei gedanklich elektrische Ladung und
elektrisches Feld des Elektrons. Setzt man die Ladung −e in das Potential  ,
wobei man sie zum Beispiel gleichmäßig auf eine Kugeloberfläche vom Radius
,
wobei man sie zum Beispiel gleichmäßig auf eine Kugeloberfläche vom Radius  verteilt denkt, so ist dafür Energie nötig, die Selbstenergie. Es gab
jedoch durchaus auch andere Herleitungen für eine mögliche Ausdehnung des
Elektrons, die auf andere Werte kamen.
verteilt denkt, so ist dafür Energie nötig, die Selbstenergie. Es gab
jedoch durchaus auch andere Herleitungen für eine mögliche Ausdehnung des
Elektrons, die auf andere Werte kamen.
Heute ist die Sichtweise bezüglich einer Ausdehnung des Elektrons eine
andere: In den bisher möglichen Experimenten zeigen Elektronen weder Ausdehnung
noch innere Struktur und können insofern als punktförmig angenommen werden. Die
experimentelle Obergrenze für die Größe des Elektrons liegt derzeit bei etwa
10−19 m. Dennoch tritt der klassische Elektronenradius
 in vielen Formeln auf, in denen aus den feststehenden Eigenschaften des
Elektrons eine Größe der Dimension Länge (oder Fläche etc.) gebildet wird, um
experimentelle Ergebnisse erklären zu können. Z.B. enthalten die
theoretischen Formeln für die Wirkungsquerschnitte
des Photo- und des Compton-Effekts das Quadrat von
in vielen Formeln auf, in denen aus den feststehenden Eigenschaften des
Elektrons eine Größe der Dimension Länge (oder Fläche etc.) gebildet wird, um
experimentelle Ergebnisse erklären zu können. Z.B. enthalten die
theoretischen Formeln für die Wirkungsquerschnitte
des Photo- und des Compton-Effekts das Quadrat von  .
.
Auch die Suche nach einem elektrischen Dipolmoment des Elektrons blieb bisher ohne positiven Befund. Ein
Dipolmoment würde entstehen, wenn bei einem nicht punktförmigen Elektron der
Schwerpunkt der Masse nicht gleichzeitig der Schwerpunkt der Ladung wäre. So
etwas wird von Theorien der Supersymmetrie,
die über das Standardmodell
der Elementarteilchen hinausgehen, vorhergesagt. Eine Messung im Oktober
2013,
die das starke elektrische Feld in einem polaren Molekül ausnutzt, hat ergeben,
dass ein eventuelles Dipolmoment mit einem Konfidenzniveau
von 90% nicht größer als 8,7•10−31  m
ist. Anschaulich bedeutet das, dass Ladungs- und Massenmittelpunkt des Elektrons
nicht weiter als etwa 10−30 m auseinander liegen können.
Theoretische Ansätze, nach denen größere Werte vorhergesagt wurden, sind damit
widerlegt.
m
ist. Anschaulich bedeutet das, dass Ladungs- und Massenmittelpunkt des Elektrons
nicht weiter als etwa 10−30 m auseinander liegen können.
Theoretische Ansätze, nach denen größere Werte vorhergesagt wurden, sind damit
widerlegt.
Wirkungsquerschnitt
Von der Ausdehnung des Elektrons zu unterscheiden ist sein Wirkungsquerschnitt
für Wechselwirkungsprozesse. Bei der Streuung von Röntgenstrahlen an
Elektronen erhält man z.B. einen Wirkungsquerschnitt, der einem effektiven
Elektronenradius von etwa 3 · 10−15 m entspräche, was
recht gut mit dem oben beschriebenen klassischen Elektronenradius übereinstimmt.
Der totale Streuquerschnitt
von Photonen an Elektronen beträgt im Grenzfall kleiner Photonenenergien  (Thomson-Streuung und Compton-Effekt).
(Thomson-Streuung und Compton-Effekt).
Wechselwirkungen
Viele physikalische Erscheinungen wie Elektrizität, Elektromagnetismus und elektromagnetische Strahlung beruhen im Wesentlichen auf Wechselwirkungen von Elektronen. Elektronen in einem elektrischen Leiter werden durch ein sich änderndes Magnetfeld verschoben und es wird eine elektrische Spannung induziert. Die Elektronen in einem stromdurchflossenen Leiter erzeugen ein Magnetfeld. Ein beschleunigtes Elektron - natürlich auch beim Fall der krummlinigen Bewegung - emittiert Photonen, die sogenannte Bremsstrahlung (Hertzscher Dipol, Synchrotronstrahlung, Freie-Elektronen-Laser).
In einem Festkörper erfährt das Elektron Wechselwirkungen mit dem Kristallgitter. Sein Verhalten lässt sich dann beschreiben, indem statt der Elektronenmasse die abweichende effektive Masse verwendet wird, die auch abhängig von der Bewegungsrichtung des Elektrons ist.
Elektronen, die sich in polaren Lösungsmitteln wie Wasser oder Alkoholen von ihren Atomen gelöst haben, werden als solvatisierte Elektronen bezeichnet. Bei Lösung von Alkalimetallen in Ammoniak sind sie für die starke Blaufärbung verantwortlich.
Ein Elektron ist ein Quantenobjekt, das heißt, bei ihm liegt die durch die Heisenbergsche Unschärferelation beschriebene Orts- und Impulsunschärfe im messbaren Bereich, so dass wie bei Licht sowohl Wellen- als auch Teilcheneigenschaften beobachtet werden können, was auch als Welle-Teilchen-Dualismus bezeichnet wird. In einem Atom kann das Elektron als stehende Materiewelle betrachtet werden.
Experimente
Das Verhältnis e/m der Elektronenladung zur Elektronenmasse kann als Schulversuch mit dem Fadenstrahlrohr ermittelt werden. Die direkte Bestimmung der Elementarladung gelang durch den Millikan-Versuch.
Bei Elektronen, deren Geschwindigkeit nicht vernachlässigbar klein gegenüber der Lichtgeschwindigkeit ist, muss der nichtlineare Beitrag zum Impuls nach der Relativitätstheorie berücksichtigt werden. Elektronen mit ihrer geringen Masse lassen sich relativ leicht auf so hohe Geschwindigkeiten beschleunigen; schon mit einer kinetischen Energie von 80 keV hat ein Elektron die halbe Lichtgeschwindigkeit. Der Impuls lässt sich durch die Ablenkung in einem Magnetfeld messen. Die Abweichung des Impulses vom nach klassischer Mechanik berechneten Wert wurde zuerst von Walter Kaufmann 1901 nachgewiesen und nach der Entdeckung der Relativitätstheorie zunächst mit dem Begriff der „relativistischen Massenzunahme“ beschrieben, der aber inzwischen als überholt angesehen wird.
Freie Elektronen
In der Kathodenstrahlröhre (Braunsche Röhre) treten Elektronen aus einer beheizten Glühkathode aus und werden im Vakuum durch ein elektrisches Feld in Feldrichtung (in Richtung der positiven Anode) beschleunigt. Durch Magnetfelder werden die Elektronen senkrecht zur Feldrichtung und senkrecht zur augenblicklichen Flugrichtung abgelenkt (Lorentzkraft). Diese Eigenschaften der Elektronen haben erst die Entwicklung des Oszilloskops, des Fernsehers und des Computermonitors ermöglicht.
Weitere Anwendungen freier Elektronen sind z.B. die Röntgenröhre, das Elektronenmikroskop, das Elektronenstrahlschweißen, physikalische Grundlagenforschung mittels Teilchenbeschleunigern und die Erzeugung von Synchrotronstrahlung für Forschungs- und technische Zwecke.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.03. 2021
