Natriumamid
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
Natriumamid ist eine farblose, grobkristalline oder pulverige Verbindung der Zusammensetzung NaNH2.
| Strukturformel | |
|---|---|
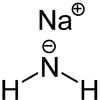 | |
| Allgemeines | |
| Name | Natriumamid |
| Summenformel | NaNH2 |
| Kurzbeschreibung | grauweißer Feststoff mit ammoniakartigem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7782-92-5 |
| EG-Nummer | 231-971-0 |
| ECHA-InfoCard | 100.029.064 |
| PubChem | 24533 |
| Eigenschaften | |
| Molare Masse | 39,01 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,39 g/cm3 |
| Schmelzpunkt | 210 °C |
| Siedepunkt | 400 °C |
| Löslichkeit | Zersetzung in Wasser |
Darstellung
Natriumamid ist im Labormaßstab aus metallischem Natrium und flüssigem Ammoniak in Gegenwart von Eisen(III)-Ionen unter Freisetzung von Wasserstoff darstellbar.
Ohne Eisenkatalysator wird nicht das Amid gebildet (anders als bei der analogen Synthese von Natriumhydroxid aus Natrium und Wasser), stattdessen kommt es zur Solvatisierung des 3s-Valenzelektrons des Natrium im Ammoniak. Die freien Elektronen führen zu einer tiefen Blaufärbung der Lösung, die gewissermaßen als ammoniakalische Lösung des hypothetischen „Salzes“ Na+e− aufgefasst werden. Dampft man die Lösung ein, wird Na+ wieder zum Element reduziert, die Ausbeute an NaNH2 beläuft sich so nur auf weniger als 0,5 %.
Eigenschaften
Natriumamid ist ein farbloser, hygroskopischer Feststoff. Es ist eine sehr starke Base, die sich zur Deprotonierung nur schwach acider Verbindungen eignet.
Reaktionsverhalten
Mit Wasser reagiert Natriumamid heftig zu Natriumhydroxid und Ammoniak. Die Heftigkeit der Reaktion ist vergleichbar mit der von Natrium und Wasser.
Durch Luftsauerstoff wird Natriumamid langsam oxidiert, wobei sich zum Teil explosive Reaktionsprodukte wie Natriumhyponitrit, Natriumtrioxodinitrat, Natriumtetraoxodinitrat sowie höhere Peroxonitrate bilden. Die Oxidationsprodukte sind hochgradig reib- und schlagempfindlich. Schon einfache Mahlungs-, Zerkleinerungs- und Umfüllarbeiten können zu heftigen Explosionen führen. Die Bildung von instabilen Oxidationsprodukten ist an der Verfärbung des Stoffes zu erkennen. Es empfiehlt sich daher die Verbindung in einer Schutzflüssigkeit (Petroleum) aufzubewahren oder besser sofort zu verbrauchen. Alte, oxidierte Präparate sind nicht mehr brauchbar und müssen unter angemessenen Vorsichtsmaßnahmen entsorgt werden.
Verwendung
Natriumamid wird in der Organischen Chemie als starke Base zur Deprotonierung wenig acider Verbindungen eingesetzt. So können zum Beispiel die stark gespannten Arine durch Umsetzung von Brombenzolderivaten mit Natriumamid durch eine E1cb-Reaktion erhalten werden. Seltener wird Natriumamid auch zur Deprotonierung von Alkoholen oder terminalen Alkinen verwendet.
So kann aus Acetylen
durch Deprotonierung gewonnenes Natriumacetylid zur Alkinylierung eingesetzt
werden. Da Natriumamid sterisch wenig anspruchsvoll ist, wird es auch zur Deprotonierung
von sterisch
schlecht zugänglichen Protonen
eingesetzt.
Des Weiteren kann es zur Herstellung von
Natriumazid verwendet
werden.
Als Nukleophil fungiert es in der Tschitschibabin-Reaktion, in der es nukleophil an einem Pyridinring unter Bildung von Aminopyridinen angreift.
Literatur
- K. Peter C. Vollhardt und Neil E. Schore: Organische Chemie 3. Auflage. Wiley-VCH, 2000, ISBN 3-527-29819-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.06. 2023


