Ammoniumnitrat
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Ammoniumnitrat ist als Ammoniumsalz ein anorganisches Salz, das sich z. B. bei der Neutralisationsreaktion des wasserlöslichen, basischen Gases Ammoniak mit Salpetersäure bildet. Das so hergestellte und getrocknete Ammoniumnitrat wird einerseits zur Herstellung von Düngemitteln verwendet, ist aber andererseits auch ein Sprengstoff, der bei nicht sachgemäßer Lagerung und Handhabung spontan explodieren kann. Auf diese Weise hat gelagertes Ammoniumnitrat schon viele schwerwiegende Unfälle verursacht.
| Strukturformel | ||
|---|---|---|

| ||
| Allgemeines | ||
| Name | Ammoniumnitrat | |
| Andere Namen | ||
| Summenformel | NH4NO3 | |
| Kurzbeschreibung | farbloser, hygroskopischer Feststoff[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 229-347-8 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 80,04 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,72 g/cm3 (20°C)[2] | |
| Schmelzpunkt | 169 °C[2] | |
| Siedepunkt | 210 °C (15 hPa), bei Normaldruck Zersetzung ab 170 °C[2] | |
| Löslichkeit | ||
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −366 kJ/mol[6] | |
Geschichte
Ammoniumnitrat wurde erstmals 1659 von Johann Rudolph Glauber durch Reaktion von Ammoniumcarbonat mit Salpetersäure hergestellt.[7] Erst zu Beginn des 19. Jahrhunderts wurde es von Grindel und Robin als Ersatz für Kaliumnitrat in Schwarzpulver für die Verwendung in Sprengstoffen in Betracht gezogen. Über seine explosiven Eigenschaften wurde 1849 von Reise und Millon berichtet, als eine Mischung aus pulverförmigem Ammoniumnitrat und Holzkohle beim Erhitzen explodierte. Zu diesem Zeitpunkt wurde Ammoniumnitrat nicht als Sprengstoff betrachtet, obwohl es weltweit zu kleinen Bränden und Explosionen mit Ammoniumnitrat kam. Ende des 19. Jahrhunderts versuchte man in Europa in Kohlenminen die Verwendung von Schwarzpulver zu beschränken und einen sicheren Sprengstoff als Ersatz zu finden. In England wurden nach Experimenten mit verschiedenen Sprengstoffen schließlich mehrere empfohlen, wovon die meisten auf Ammoniumnitrat basierten. Sowohl Dynamit als auch Schwarzpulver fielen bei den Tests durch und wurden durch Sprengstoffe auf der Basis von Ammoniumnitrat ersetzt. Die von diesem Ausschuss erzielten Ergebnisse führten zum englischen Kohlebergbau-Verordnungsgesetz von 1906. Bis 1913 erreichte die britische Kohleförderung mit 287 Millionen Tonnen einen historischen Höchststand, wobei jährlich mehr als 5000 Tonnen Sprengstoff verbraucht wurden, wovon ab 1917 92 % dieser Sprengstoffmenge auf Ammoniumnitrat basierte. Um die Kosten für Sprengstoffzusammensetzungen zu senken, fügte die Sprengstoffindustrie den Formulierungen mehr von der billigeren Verbindung Ammoniumnitrat hinzu, was jedoch den unglücklichen Nebeneffekt hatte, dass die Empfindlichkeit der Sprengstoffe gegenüber Feuchtigkeit erhöht wurde. Die Chemiker überwanden dieses Problem, indem sie das Ammoniumnitrat mit verschiedenen anorganischen Pulvern beschichteten, und bzw. oder es mit Dynamit mischten. Auch die Verpackung der Sprengstoffe wurde verbessert, um das Eindringen von Feuchtigkeit zu verhindern.[8]
Nach Ende des Ersten Weltkrieges wurde in einem Chemiewerk der BASF in Ludwigshafen-Oppau in großem Umfang Ammoniumnitrat als Düngemittel hergestellt. Um die für die Verwendung als Düngemittel ungünstigen hygroskopischen Eigenschaften von Ammoniumnitrat zu verbessern, wurde anfangs Kaliumchlorid zugefügt, was zu einer Umwandlung in ein Gemisch aus Ammoniumchlorid und Kaliumnitrat führte, was als Kalkammonsalpeter bezeichnet wurde. Später wurde das Kaliumchlorid durch Ammoniumsulfat ersetzt, wodurch ein Produkt entstand, das als Ammonsulfatsalpeter (chemisch Ammoniumsulfatnitrat) bezeichnet wurde. Der Begriff Leunasalpeter, der sich auf die Leuna-Fabrik der BASF bezieht, wird manchmal als Synonym für Ammonsulfatsalpeter verwendet. Der in Oppau produzierte Ammonsulfatsalpeter wurde oft einfach als Mischsalz bezeichnet. Dieses Produkt ist eine Quelle sowohl für primäre (Stickstoff) als auch für sekundäre (Schwefel) Pflanzennährstoffe. Die Mischung der beiden Verbindungen bildet entweder nur eine Mischung der beiden Verbindungen oder Doppelsalze (2AN-AS oder 3AN-AS), je nach Herstellungsverfahren und Mischungsverhältnissen. Die Bildung von Doppelsalzen aus AN und AS ist seit 1909 aus den Arbeiten des niederländischen Physikochemikers Franciscus A. H. Schreinemakers (1864–1945) bekannt. Am Morgen des 21. September 1921 kam es in dem Werk in Oppau zu zwei kurz aufeinanderfolgenden Explosionen von etwa 400 Tonnen Ammoniumsulfatnitrat, bei der mehr als 500 Menschen starben.[9] Diese Explosion zog umfangreiche Untersuchungen zu dem Unglück und Studien zu den Eigenschaften von Ammoniumsulfatnitrat, aber auch Ammoniumnitrat nach sich.[10]
Nach dem Ende des Zweiten Weltkriegs begann die Regierung der USA mit der Lieferung von so genanntem Ammoniumnitrat in Düngemittelqualität (FGAN) nach Europa, das aus körnigem Ammoniumnitrat bestand, das mit etwa 0,75 % Wachs beschichtet und mit etwa 3,5 % Ton konditioniert war. Da dieses Material nicht als Sprengstoff galt, wurden bei der Handhabung und dem Transport keine besonderen Vorsichtsmaßnahmen getroffen – die Arbeiter rauchten sogar während der Verladung des Materials. Bis zum 16. und 17. April 1947 wurden zahlreiche Transporte ohne Schwierigkeiten durchgeführt, bis sich eine schwere Explosion ereignete. Die SS Grandchamp und die SS Highflyer, die beide im Hafen von Texas City vor Anker lagen und mit FGAN beladen waren, explodierten. Als Folge dieser Katastrophen wurde in den USA eine Reihe von Untersuchungen eingeleitet, um die möglichen Ursachen der Explosionen zu ermitteln. Gleichzeitig wurde auch eine gründlichere Untersuchung der explosiven Eigenschaften von Ammoniumnitrat und seiner Mischungen mit organischen und anorganischen Materialien durchgeführt. Kaum hatte die Explosion in Texas City stattgefunden, erschütterte eine ähnliche Explosion an Bord der SS Ocean Liberty am 28. Juli 1947 den Hafen von Brest in Frankreich. Die Untersuchungen zeigten, dass Ammoniumnitrat viel gefährlicher war als bisher angenommen und strengere Vorschriften, die ihre Lagerung, Verladung und ihren Transport in den USA regeln, wurden umgehend in Kraft gesetzt.[8]
In den 1970er Jahren begannen die US-Firmen Ireco und DuPont damit, ihren Formulierungen Aluminium und Monomethylaminnitrat (MAN) beizufügen, um gelierte Sprengstoffe herzustellen, die leichter explodieren können. Neuere Entwicklungen betreffen die Herstellung von Emulsionssprengstoffen (zum Teil mit Mischungen aus Ammonium- und Natriumnitrat), die Tröpfchen einer Lösung von Ammoniumnitrat in Öl enthalten.[8]
Herstellung

Ammoniumnitrat (NH4NO3) entsteht durch Neutralisation von Ammoniak mit Salpetersäure.
Die Reaktion verläuft mit einer molaren Reaktionsenthalpie von −146 kJ·mol−1 stark exotherm.[4]
Eigenschaften
Physikalische Eigenschaften
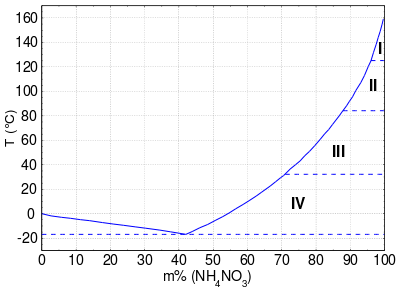
Ammoniumnitrat bildet farblose hygroskopische Kristalle, die bei 169,6 °C schmelzen. Der Feststoff kann in fünf verschiedenen polymorphen Kristallformen vorliegen, mit Umwandlungstemperaturen bei −16,9 °C, 32,3 °C, 84,2 °C und 125,2 °C.[4][11] Für die Neigung von Ammoniumnitrat-Kristallen zum Zusammenbacken sind dabei namentlich die ersten beiden Phasenumwandlungen in Nähe der Raumtemperatur verantwortlich. Die polymorphen Formen treten in verschiedenen Kristallgittern auf:
Kristallgitter der Modifikationen[4] Polymorph I 169,6 °C … 125,2 °C kubisch Polymorph II 125,2 °C … 84,2 °C tetragonal Polymorph III 84,2 °C … 32,2 °C orthorhombisch Polymorph IV 32,2 °C … −16,9 °C orthorhombisch Polymorph V < −16,9 °C tetragonal
Der Phasenübergang zwischen den Polymorphen IV und III bei 32,2 °C ist bei der Handhabung, aber auch bei der Lagerung der Substanz relevant. In Formulierungen für Düngemittel oder Sprengstoffe kann dieses Verhalten zu unerwünschten Änderungen der Morphologie und damit der Eigenschaften führen. Durch Dotierung mit verschiedenen Salzen kann dieser Phasenübergang unterdrückt werden, um sogenanntes phasenstabilisiertes Ammoniumnitrat zu erhalten. Geeignete Salze können verschiedene Kaliumsalze, wie Kaliumfluorid, Kaliumchlorid, Kaliumnitrat, Kaliumcarbonat, Kaliumsulfat, Kaliumrhodanid und Kaliumdichromat sein, die allerdings mit einem Anteil von 1 bis 2 Ma% (Massenprozent) zugesetzt werden müssen.[12] Der Effekt kann auch mit einer wesentlich geringeren Menge von 0,1 Ma% Kaliumhexacyanidoferrat(II) K4[Fe(CN)6] · 3 H2O erreicht werden.[13][14]
Mit der hygroskopischen Eigenschaft des Ammoniumnitrats ist eine starke Schmelzpunktabsenkung verbunden: Schon eine Wasseraufnahme von nur 1 Ma% senkt den Schmelzpunkt des Salzes auf etwa 156 °C. Umgekehrt zeigt das Phasendiagramm bei einem Ammoniumnitratgehalt von 42 Ma% ein Eutektikum mit einem Schmelzpunkt von −16,9 °C.[4] Das in Wasser sehr leicht lösliche Ammoniumnitrat bewirkt also bis zu einem Gehalt von 42 Ma% eine Schmelzpunkterniedrigung des Wassers, worauf seine Anwendung u. a. in Kältemischungen beruht.[15] Bei höheren Massenanteilen liegt das Ammoniumnitrat in zwei Phasen vor, zum einen der wässrigen Lösung, zum anderen dem Salz selbst als festem Bodensatz (bei 20 °C ab ca. 65 Ma%, bei 100 °C ab ca. 91,5 Ma%):
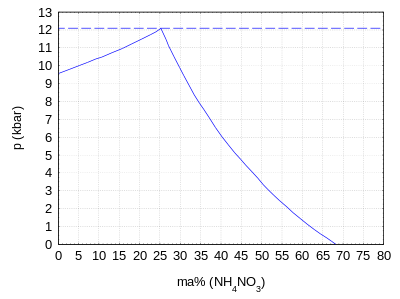
Bei hohem Druck sinkt die Wasserlöslichkeit drastisch: Bei Normaldruck und 25 °C enthält das Gemisch noch 67,6 Ma% Ammoniumnitrat, bis zu einem Druck von 12 kbar sinkt dieser Anteil auf nur noch 25,4 Ma%.[3] Bei einem Druck von 12,1 kbar und einem Gehalt von 25,3 Ma% schneiden sich die Phasengrenzlinien zwischen der einphasigen Lösung und dem zweiphasigen Gemisch aus Lösung und Eis bzw. aus Lösung und Ammoniumnitrat als Polymorph IV.[3] Oberhalb dieses Druckes liegt ein zweiphasiges Gemisch aus Eis und festem Ammoniumnitrat vor und es kann keine Lösung mehr existieren.
Die Dichte von reinem Ammoniumnitrat beträgt 1,725 g/cm3.[4] In wässriger Lösung steigt die Dichte mit steigender Konzentration bzw. sinkt mit steigender Temperatur.[4]
Dichte von wässrigen Ammoniumnitratlösungen bei verschiedenen Temperaturen[4] Gehalt (Ma%) 20 % 30 % 40 % 50 % 60 % 70 % 80 % 90 % 94 % 20 °C 1,0830 1,1275 1,1750 1,2250 1,2785 40 °C 1,0725 1,1160 1,1630 1,2130 1,2660 1,3220 60 °C 1,0620 1,1045 1,1510 1,2005 1,2525 1,3090 1,3685 80 °C 1,0550 1,0935 1,1390 1,1875 1,2395 1,2960 1,3550 100 °C 1,0410 1,0820 1,1270 1,1745 1,2265 1,2825 1,3420 1,4075 120 °C 1,3285 1,3930 1,4210 140 °C 1,3785 1,4065 160 °C 1,3940
In Methanol ergeben sich bei 30 °C eine 20%ige bzw. bei 60 °C eine 40%ige Lösung.[4] Die Löslichkeit in Ethanol ist wesentlich geringer. Hier kann bei 20 °C nur eine 4%ige Lösung erhalten werden.[4]
Chemische Eigenschaften
Beim Erhitzen (T > 170 °C) zerfällt Ammoniumnitrat gemäß der Gleichung[16]
in Wasser und Lachgas. Durch starke Initialzündung zerfällt es folgendermaßen:
Das Stickstoffatom des Nitrat-Ions NO3− (Oxidationsstufe +V) oxidiert dabei das Stickstoffatom des Ammonium-Ions NH4+ (Oxidationsstufe −III), so dass sich am Ende, im N2-Molekül, beide Stickstoffatome auf gleicher Oxidationsstufe (hier 0) befinden. Reaktionen dieser Art, bei denen Atome andere Atome desselben Elements oxidieren und dabei selbst reduziert werden, so dass sich am Ende alle auf gleicher Oxidationsstufe befinden, heißen Komproportionierungen.
Der explosionsartige Übergang vom Feststoff (NH4NO3) zu ausnahmslos gasförmigen Produkten (H2O, N2 und O2) dieser Reaktion erklärt die hohe Sprengkraft des Ammoniumnitrats: Mit etwa 980 l/kg[11] besitzt es eines der höchsten spezifischen Schwadenvolumen, und kalkuliert man auch noch seine Dichte mit ein, ergibt sich ein sogar noch höheres Verhältnis (Schwadenvolumen/Sprengstoffvolumen). Weitere wichtige Explosionskennzahlen sind:[11]
- Explosionswärme: 2625 kJ·kg−1
- Detonationsgeschwindigkeit: 2500 m·s−1 bei einer Dichte von 1,4 g·cm−3
- Bleiblockausbauchung: 180 cm3/10 g
- Schlagempfindlichkeit: 49 N·m
- Reibempfindlichkeit: Bis 353 N Stiftbelastung keine Reaktion
- Stahlhülsentest: Grenzdurchmesser 1,0 mm
Durch Reaktion mit konzentrierter Schwefelsäure und anschließender Destillation lässt sich die Salpetersäure zurückgewinnen, welche die Ausgangssubstanz zur Herstellung vieler Explosivstoffe ist:
Verwendung
Ammoniumnitrat ist Hauptbestandteil vieler Düngemittel (Ammoniumnitrat-Harnstoff-Lösung), Mehrnährstoffdünger („Blaukorn“), Kalkammonsalpeter (Nitramoncal, Markenname der ehemaligen Chemie Linz, heute Borealis, intern NAC).
Außerdem wird es für Sprengstoffe genutzt. Ammoniumnitrat ist beispielsweise in den Sprengmitteln ANC, Donarit und Kinepak enthalten.
Auch als Treibmittel für Airbags in Kraftfahrzeugen wurde Ammoniumnitrat zeitweise verwendet. Es erwies sich allerdings insbesondere unter dem Einfluss von hoher Umgebungstemperatur und Luftfeuchtigkeit als nicht ausreichend langzeitstabil und wurde durch andere Treibmittel abgelöst.[17] Allein in den USA mussten über 40 Millionen Fahrzeuge zurückgerufen werden, weil mindestens ein Airbag einen Gasgenerator mit Ammoniumnitrat enthielt.[18]
Obwohl es als brandfördernd gilt und beim Erhitzen explodieren kann, gehört Ammoniumnitrat nicht zu den eigentlich explosionsgefährlichen Stoffen im Sinne des Sprengstoffgesetzes.[11] Gleichwohl wird der Umgang mit ihm in der Bundesrepublik Deutschland durch das Sprengstoffgesetz geregelt, und so darf Ammoniumnitrat wegen seiner möglichen Gefährlichkeit in Düngemitteln inzwischen nur noch gemischt mit harmlosen Stoffen wie Kalk verwendet werden (KAS27). Typische Konzentrationen beim Hersteller Chemie Linz waren ehemals 26 und 28 % N (Stickstoffgehalt). Heute üblich ist 27 % N, was etwa 70 % NH4NO3 und Rest Kalk sowie etwas Öl gegen das Zusammenbacken der Kugeln bedeutet. Höhere Stickstoffgehalte bis 46 % sind durch Harnstoff realisierbar, sein Amidstickstoff ist langsamer verfügbar.
Wegen seiner Gefährlichkeit zählt die EU Ammoniumnitrat mit einem Stickstoffgehalt im Verhältnis zum Ammoniumnitrat von mehr als 16 % seit 1. Februar 2021 zu den beschränkten Ausgangsstoffen für Explosivstoffe mit der Folge, dass die Abgabe an und die Verwendung, der Besitz und die Verbringung durch Personen verboten ist, sofern diese nicht zu beruflichen oder gewerblichen Zwecken tätig werden; die berufliche oder gewerbliche Zweckbestimmung ist bei Verkauf zu überprüfen und verdächtige Transaktionen und Diebstahl sind meldepflichtig.[19] Bereits seit 27. Juni 2010 (mit Übergangsregelungen bis 1. Juli 2014) war das Inverkehrbringen von Gemischen mit diesem Stickstoffgehalt von über 16 % in der EU außer an Landwirte und entsprechende gewerbliche Verwender verboten.[20]
Katastrophen
Ammoniumnitrat ist die Ursache zahlreicher Explosionskatastrophen:[21]
- Explosion des Ammoniakwerkes der BASF in Oppau (heute ein Stadtteil von Ludwigshafen am Rhein) am 21. September 1921: Festgewordener Ammoniumsulfatnitrat-Dünger wurde dort üblicherweise vor dem Ausschleusen mittels Dynamit aufgelockert. Der Dünger galt zu dieser Zeit entsprechend dem Stand des Wissens als nicht explosionsfähig. Aufgrund einer Änderung des Produktionsverfahrens kam es vermutlich zu einer lokalen Anreicherung von Ammoniumnitrat im Produkt. Durch die Sprengungen wurden zwei kurz aufeinanderfolgende Explosionen ausgelöst, bei denen in einem Silo ca. 400 von insgesamt 4500 Tonnen Düngemittel detonierten und so einen der größten Explosionsschäden der Geschichte verursachten: 559 Menschen wurden getötet, 1977 verletzt und ein großer Teil der Fabrik sowie der umliegenden Bebauung wurden zerstört.[22] Die Explosion war bis in das 300 Kilometer entfernte München zu hören.[23]
- Bei der Texas-City-Explosion am 16. April 1947 explodierten im Hafen von Texas City in den Vereinigten Staaten die beiden mit ca. 2300 Tonnen Ammoniumnitrat beladenen Frachter Grandcamp (Frankreich) und Highflyer (USA). Es gab 500 bis 600 Tote,[24] über 100 Vermisste, 8000 Verletzte, Hunderte Obdachlose und 65 Millionen US-Dollar Schaden.
- Am 28. Juli 1947 explodierte im Hafen von Brest (Frankreich) der mit Ammoniumnitrat beladene Frachter Ocean Liberty (Norwegen). Es gab 26 Tote und über 100 Verletzte.[25][26]
- Am 9. Januar 1963 kam es in Oulu (Finnland) zu einer Explosion in einer Stickstofffabrik, bei der 10 Angestellte starben.[27][28]
- Beim Bombenanschlag auf das Murrah Federal Building in Oklahoma City am 19. April 1995 in den USA ermordete der rechtsextreme Terrorist Timothy McVeigh 168 Menschen, darunter 19 Kinder in einem Kindergarten, und verletzte mehr als 800 weitere Personen, indem er eine Autobombe mit einem von ihm selbst hergestellten, 2,4 Tonnen schweren Sprengsatz aus Ammoniumnitrat und Nitromethan zur Detonation brachte und damit ein achtstöckiges Verwaltungsgebäude zum Einsturz brachte. Über 300 weitere Gebäude wurden beschädigt.
- Genau 80 Jahre nach der Explosion des Oppauer Ammoniakwerkes (siehe oben) starben am 21. September 2001 bei einer Ammoniumnitrat-Explosion in der Düngemittelfabrik AZF im französischen Toulouse 31 Menschen. Auch hier gab es darüber hinaus tausende Verletzte und riesige Sachschäden.
- Beim Eisenbahnunfall von Ryongchŏn am 22. April 2004 kam es im nordkoreanischen Ryongchŏn zur Explosion eines mit Ammoniumnitrat beladenen Zugwaggons, bei der mindestens 161 Menschen starben. Schätzungsweise 1300 Menschen wurden verletzt und 8000 Häuser zerstört oder beschädigt.[29]
- Am 24. Mai 2004 explodierte in der Gemeinde Mihăilești Kreis Buzău Rumänien bei einem Autounfall ein LKW mit 20 Tonnen Ammoniumnitrat. Es gab 18 Tote und 13 Schwerverletzte. Durch die Explosion bildete sich ein Krater von 6,5 m Tiefe und 21 m Durchmesser.[30][31][32][29]
- Am 22. Juli 2011 brachte der rechtsextreme Attentäter Anders Behring Breivik als Teil seiner Anschlagsserie in Norwegen im Osloer Regierungsviertel eine Autobombe auf Basis von 950 Kilogramm ANFO (Ammoniumnitrat und Dieselöl) zur Explosion. 8 Menschen kamen ums Leben, 10 weitere wurden verletzt.
- Bei einem Brand und einer heftigen Explosion in der West Fertilizer Company in Texas am 17. April 2013 starben mindestens 14 Menschen und 180 weitere wurden verletzt.[33][34]
- Am 12. August 2015 wurden bei einer Explosion im chinesischen Tianjin hunderte Menschen getötet bzw. verletzt. Laut der britischen Zeitung The Guardian waren vor Ort neben zahlreichen anderen Substanzen 800 Tonnen Ammoniumnitrat gelagert.[35] Diese Menge ist geeignet, den ca. 100 m breiten Krater zu erklären, den die Explosion hinterließ. Welche Substanz den Hauptanteil an der Zerstörung hatte, ist nicht bekannt.
- Am 4. August 2020 zerstörte eine gewaltige Explosion von – nach Angaben des libanesischen Ministerpräsidenten – 2750 Tonnen Ammoniumnitrat den Hafen von Beirut sowie weite Teile der Umgebung. Die Explosion war noch hunderte Kilometer weit zu hören.[36]
Einzelnachweise
- ↑ Eintrag zu
 AMMONIUM NITRATE
in der CosIng-Datenbank der EU-Kommission.
AMMONIUM NITRATE
in der CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b c d
e f Eintrag zu
 Ammoniumnitrat in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Ammoniumnitrat in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b c Rolf K. Freier: Wäßrige Lösungen, Bd. 2, Ergänzungen. 1978, ISBN 978-3-11-006537-4, S. 324.
- ↑ Hochspringen nach: a b c
d e f g
h i j k
l Karl-Heinz Zapp, Karl-Heinz Wostbrock, Manfred Schäfer, Kimihiko Sato, Herbert Seiter, Werner Zwick, Ruthild Creutziger, Herbert Leiter:
Ammonium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30673-2, Ammonium Compounds,
doi:
 10.1002/14356007.a02_243.
10.1002/14356007.a02_243.
- ↑ Dimethyl Sulfoxide (DMSO) Solubility Data. In: Gaylord Chemical Company, L.L.C (Hrsg.):
Bulletin 102. Juni 2014, S. 15
(
 gaylordchemical.com
[PDF; abgerufen am 28. Juni 2025]).
gaylordchemical.com
[PDF; abgerufen am 28. Juni 2025]).
- ↑ Frank-Michael Becker u. a: Formelsammlung. 3. Auflage. Paetec, Berlin 2003, ISBN 3-89818-700-4, S. 116.
- ↑ Vaclav Smil: Creating the Twentieth Century: Technical Innovations of 1867–1914 and Their Lasting Impact. Oxford University Press,
2005, ISBN 978-0-19-803774-3, S. 185
(
 books.google.de).
books.google.de).
- ↑ Hochspringen nach: a b c
Jacqueline Akhavan: The Chemistry of Explosives. Royal Society of Chemistry, 2011, ISBN 978-1-84973-330-4,
S. 5
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Tor E. Kristensen:
 A factual clarification and chemical-technical reassessment of the 1921 Oppau
explosion disaster the unforeseen explosivity of porous ammonium sulfate nitrate fertilizer. 16/01508. In: FFI-RAPPORT. Norwegian Defence Research Establishment / Forsvarets
forskningsinstitutt, 4. Oktober 2016, S. 20, abgerufen am 28. Juni 2025 (englisch).
A factual clarification and chemical-technical reassessment of the 1921 Oppau
explosion disaster the unforeseen explosivity of porous ammonium sulfate nitrate fertilizer. 16/01508. In: FFI-RAPPORT. Norwegian Defence Research Establishment / Forsvarets
forskningsinstitutt, 4. Oktober 2016, S. 20, abgerufen am 28. Juni 2025 (englisch).
- ↑ George Stanley Scott, R. L. Grant: Ammonium Nitrate –
Its Properties and Fire and Explosion Hazards. U.S. Department of the Interior, Bureau of Mines, 1948, S. 23
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hochspringen nach: a b c d Rudolf Meyer, Josef Köhler, Axel Homburg, Rudolf Meyer, Axel Homburg: Explosivstoffe. 10., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-62341-9.
- ↑ C. Oommen, S. R. Jain: Phase Modification of Ammonium Nitrate by Potassium Salts. In:
Journal of Thermal Analysis and Calorimetry. Band 55,
Nr. 3, 1999, S. 903–918,
doi:
 10.1023/A:1010146203523.
10.1023/A:1010146203523.
- ↑ Anuj A. Vargeese, Satyawati S. Joshi, V. N. Krishnamurthy: Use of potassium ferrocyanide as habit modifier in the size reduction
and phase modification of ammonium nitrate crystals in slurries. In: Journal of Hazardous Materials.
Band 180, Nr. 1, 2010,
S. 583–589,
doi:
 10.1016/j.jhazmat.2010.04.073.
10.1016/j.jhazmat.2010.04.073.
- ↑ Anuj A. Vargeese, Krishnamurthi Muralidharan, V. N. Krishnamurthy: Thermal stability of habit modified ammonium nitrate:
Insights from isoconversional kinetic analysis. In: Thermochimica Acta. Band 524,
Nr. 1, 2011, S. 165–169,
doi:
 10.1016/j.tca.2011.07.009.
10.1016/j.tca.2011.07.009.
- ↑ Bernd Engels, Reinhold Fink, Tanja Schirmeister, Carsten Schmuck: Chemie für Mediziner. 1. Auflage. Addison-Wesley in Pearson Education Deutschland, München 2008, ISBN 978-3-8273-7286-4.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 65.
- ↑ Neil Gough, Jonathan Soble, Hiroko Tabuchi:
 Defective Takata Airbag Grows Into Global Problem for Manufacturer. In:
New York Times online. 18. November 2014, 28. Juni 2025 (englisch).
Defective Takata Airbag Grows Into Global Problem for Manufacturer. In:
New York Times online. 18. November 2014, 28. Juni 2025 (englisch).
- ↑
 Takata Airbag Recall:
Everything You Need to Know. In: Consumer Reports. 29. März 2013,28. Juni 2025 (englisch).
Takata Airbag Recall:
Everything You Need to Know. In: Consumer Reports. 29. März 2013,28. Juni 2025 (englisch).
- ↑ Art. 5 der
 Verordnung (EU) 2019/1148 des
Europäischen Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe mit Anhang I, Inkrafttreten Art. 23, Prüfungs- und Meldepflichten der Wirtschaftsteilnehmer
und Online-Marktplätze Art. 8 und 9. In Deutschland sind Verstöße gegen das Besitz-, Verwendungs-, Verbringungs- und Abgabeverbot nach
Verordnung (EU) 2019/1148 des
Europäischen Parlaments und des Rates vom 20. Juni 2019 über die Vermarktung und Verwendung von Ausgangsstoffen für Explosivstoffe mit Anhang I, Inkrafttreten Art. 23, Prüfungs- und Meldepflichten der Wirtschaftsteilnehmer
und Online-Marktplätze Art. 8 und 9. In Deutschland sind Verstöße gegen das Besitz-, Verwendungs-, Verbringungs- und Abgabeverbot nach
 § 13 Ausgangsstoffgesetz strafbar
§ 13 Ausgangsstoffgesetz strafbar
- ↑ Art. 67 Verordnung (EG) Nr. 1906/2006 mit Anhang XVII, Eintrag 58.
- ↑ Hans Schuh:: Das Rätsel von Toulouse. In: Die Zeit.
Nr. 41, 2001, S. 39
(
 zeit.de – Review über Ammoniumnitratkatastrophen.).
zeit.de – Review über Ammoniumnitratkatastrophen.).
- ↑ Christian Haller: Das Explosionsunglück in der BASF vom 21. September 1921. Katastrophenwahrnehmung und -verarbeitung in Presse, Politik und Fachwelt. In: Zeitschrift für die Geschichte des Oberrheins. Nr. 161, 2013, S. 327–328.
- ↑ R. M. Goody: The Physics of the Stratosphere. Cambridge University Press, 2014,
ISBN 978-1-107-69606-8, S. 32
(
 Volltext in der Google-Buchsuche).
Volltext in der Google-Buchsuche).
- ↑
 Aftermath.
(vom 26. November 2015 im Internet Archive) In: The 1947 Texas City Disaster. Moore Memorial Public Library, 2. April 2007 (englisch).
Aftermath.
(vom 26. November 2015 im Internet Archive) In: The 1947 Texas City Disaster. Moore Memorial Public Library, 2. April 2007 (englisch).
- ↑ Emina Mamaca u. a.: Review of Chemical Spills at Sea and Lessons Learnt. 2009, S. 17 (Interspill-Konferenz des Centre of Documentation, Research and Experimentation on Accidental Water Pollution).
- ↑ Sébastien Panou:
 28
juillet 1947, l'Ocean Liberty explose. In: maville.com. brest.maville.com, 28. Juli 2007, abgerufen am 28. Juni 2025 (französisch).
28
juillet 1947, l'Ocean Liberty explose. In: maville.com. brest.maville.com, 28. Juli 2007, abgerufen am 28. Juni 2025 (französisch).
- ↑
 Kohtalokkaasta tehdasräjähdyksestä 55 vuotta – koko Oulun kaupunki vavahteli ja
uhreja on vieläkin kateissa. Abgerufen am 28. Juni 2025 (finnisch).
Kohtalokkaasta tehdasräjähdyksestä 55 vuotta – koko Oulun kaupunki vavahteli ja
uhreja on vieläkin kateissa. Abgerufen am 28. Juni 2025 (finnisch).
- ↑
 Kun Typpi räjähti, koko Oulu heräsi –
oululaisten mieleen syöpyneen Typpi Oy:n räjähdyksen aiheutti sama ammoniumnitraatti kuin Beirutin räjähdyksen. Abgerufen am 28. Juni 2025 (finnisch).
Kun Typpi räjähti, koko Oulu heräsi –
oululaisten mieleen syöpyneen Typpi Oy:n räjähdyksen aiheutti sama ammoniumnitraatti kuin Beirutin räjähdyksen. Abgerufen am 28. Juni 2025 (finnisch).
- ↑ Hochspringen nach: a b V. Babrauska: Explosions of ammonium nitrate fertilizer in
storage or transportation are preventable accidents in J. Hazard. Mat. 304 (2016) 134–149,
doi:
 10.1016/j.jhazmat.2015.10.040.
10.1016/j.jhazmat.2015.10.040.
- ↑ Pittman, W.; Zhe Han; Harding, B.; Rosas, C.; Jiaojun Jiang; Pineda, A.; Mannan, M.S.: Lessons to be learned from an analysis of
ammonium nitrate disasters in the last 100 years in J. Hazard. Mat. 280 (2014) 472–477,
doi:
 10.1016/j.jhazmat.2014.08.037.
10.1016/j.jhazmat.2014.08.037.
- ↑ Z. Török, L.A. Kovacs, A. Ozunu: Ammonium nitrate Explosions. case study: the mihöilesti accident (2004), Romania in EcoTerra, 2 (2015) 56–60.
- ↑ G. Marlair, M.-A. Kordek: Safety and security issues relating to low capacity storage of AN-Based Fertilizers in J. Hazard. Mat. 123 (2005) 13–28,
doi:
 10.1016/j.jhazmat.2005.03.028.
10.1016/j.jhazmat.2005.03.028.
- ↑ Deadly Texas blast 'like tornado'. In: BBC News.
BBC News, 18. April 2013 (
 bbc.com).
bbc.com).
- ↑
 Düngerwerk in Texas: Explosion hinterlässt Bild der Verwüstung. In:
orf.at. news.ORF.at, 13. April 2013, abgerufen am 28. Juni 2025.
Düngerwerk in Texas: Explosion hinterlässt Bild der Verwüstung. In:
orf.at. news.ORF.at, 13. April 2013, abgerufen am 28. Juni 2025.
- ↑ Fergus Ryan: Tianjin explosions: warehouse 'handled toxic chemicals without licence' – reports. In:
The Guardian. 2015 (
 theguardian.com).
theguardian.com).
- ↑
 Beirut: Woher stammt das gefährliche Ammoniumnitrat?
In: tagesschau.de. Abgerufen am 28. Juni 2025.
Beirut: Woher stammt das gefährliche Ammoniumnitrat?
In: tagesschau.de. Abgerufen am 28. Juni 2025.
Literatur
- Ausschuss für Gefahrstoffe (Hrsg.):
 Technische Regel für Gefahrstoffe. TRGS 511 Ammoniumnitrat.
(PDF; 431 kB). November 2008
Technische Regel für Gefahrstoffe. TRGS 511 Ammoniumnitrat.
(PDF; 431 kB). November 2008 - Richard Escales: Ammonsalpetersprengstoffe. Books on Demand, Norderstedt 2002, ISBN 3-8311-3563-0 (Nachdruck der Ausgabe von 1909)
- Erica Lotspeich, Vilem Petr: The Characterization of Ammonium Nitrate MiniPrills. Kapitel 45 in Dynamic Behavior of Materials, Volume 1: Proceedings of the 2014 Annual Conference on Experimental and Applied Mechanics,
Springer, 2014, S. 319 ff. (
 Googlebooks)
Googlebooks) - K. Hahnefeld, R. Gill, G. Buske: Einflußgrößen auf Detonationsfähigkeit von Ammoniumnitrat. Wirtschaftsverlag NW, Bremerhaven 1983, ISBN 3-88314-308-1.
- W. Pittman, Zhe Han, B. Harding, C. Rosas, Jiaojun Jiang, A. Pineda, M. S. Mannan: Lessons to be learned from an analysis of ammonium nitrate disasters in the last 100 years. In:
J. Hazard. Mat. 280, 2014, S. 472–477,
 doi:10.1016/j.jhazmat.2014.08.037
doi:10.1016/j.jhazmat.2014.08.037


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.07. 2025