
Kaliumcarbonat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 1870 mg/kg (LD50, Ratte, oral) | ||||||
Kaliumcarbonat (fachsprachlich) oder Kaliumkarbonat (Trivialname: Pottasche), K2CO3, ist ein Alkali und das Kaliumsalz der Kohlensäure. Es bildet ein weißes, hygroskopisches Pulver mit einer Schmelztemperatur von 891 °C und einer Dichte von 2,428 g/cm3. Der Name Pottasche stammt von der alten Methode zur Anreicherung von Kaliumcarbonat aus Pflanzenasche (vor allem Holz-, aber auch Seetangasche) durch Auswaschen mit Wasser (daher auch die Bezeichnung als ein „Laugensalz“) und anschließendes Eindampfen in Pötten (Töpfen). Der traditionelle Name stand auch Pate für die englischen Namen potash und potassium, wobei potash viele mineralische Kaliumsalze einschließt (z.B. Kaliumchlorid) und besser mit Kalisalz übersetzt werden sollte.
| Strukturformel | ||
|---|---|---|
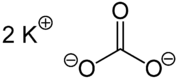 | ||
| Allgemeines | ||
| Name | Kaliumcarbonat | |
| Andere Namen | ||
| Summenformel | K2CO3 | |
| Kurzbeschreibung | weißer, hygroskopischer Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 209-529-3 | |
| ECHA-InfoCard | 100.008.665 | |
| PubChem | 11430 | |
| ChemSpider | 10949 | |
| DrugBank | DB13977 | |
| Eigenschaften | ||
| Molare Masse | 138,20 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 2,428 g/cm3 | |
| Schmelzpunkt | 891 °C | |
| Siedepunkt | Zersetzung | |
| Löslichkeit | sehr leicht in Wasser (1120 g/l bei 20 °C) | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −1151,0 kJ/mol | |
Vorkommen
Die weltweit größten Kalisalzvorkommen liegen in Kanada, Russland, Eritrea, Belarus und Deutschland; auch in einigen Binnengewässern wie dem Toten Meer oder der Wüste Lop Nor findet sich Kaliumcarbonat. Früher wurde Pottasche vorwiegend aus Holzasche durch Auslaugen gewonnen. Der Gehalt mineralischer Bestandteile an Holzasche liegt bei etwa 85 %; etwa 14–19 % davon sind Kaliumcarbonat und Natriumcarbonat.
Gewinnung und Darstellung
- Carbonisierung von Kalilauge:
- Als CO2-Quelle nutzt man überwiegend Verbrennungsgase.
- Reaktion von Kalkmilch (Calciumhydroxid-Lösung) mit Kaliumsulfat und Kohlenmonoxid bei 30 bar (Formiatverfahren). Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen in Aschenhäusern (historisch, technisch keine Bedeutung mehr)
- historisch: Brennen von Weinstein (Tartarus calcinatus ist gebrannter Weinstein), etwa bei Paracelsus
Kaliumcarbonat lässt sich nicht wie Natriumcarbonat nach dem Ammoniak-Soda-Verfahren gewinnen, da das Zwischenprodukt Kaliumhydrogencarbonat (KHCO3) zu gut löslich ist.
Eigenschaften
In Wasser ist es sehr leicht und gut löslich (1120 g/l), wobei Wärme frei wird. Die Lösung reagiert durch Bildung von Hydroxidionen alkalisch:
- Ein Carbonation reagiert mit Wasser zu einem Hydrogencarbonation und einem Hydroxidion.
Mit Säuren entstehen unter Kohlendioxidentwicklung die entsprechenden Kaliumsalze. Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung.
Wasserfreies Kaliumcarbonat kristallisiert monoklin, Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 5,640 Å, b = 9,839 Å, c = 6,874 Å und β = 98,70°. Bei 250 °C geht diese in die monokline β-Form über (Raumgruppe C2/c (Nr. 15), a = 5,675 Å, b = 9,920 Å, c = 7,018 Å und β = 96,8°). Bei 450 °C geht diese in eine hexagonale Form über.
Verwendung

- Zusatz bei der Herstellung von Glas
- Herstellung von Schmierseifen
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen -->Entwicklern
- Herstellung von Düngemitteln (kaliumliefernde Komponente)
- Wasserfreies Kaliumcarbonat wird im Laborbereich gelegentlich als Trocknungsmittel eingesetzt.
- Triebmittel für Flachgebäck (Plätzchen und Lebkuchen, besonders Weihnachtsbäckerei) und Teige mit hohem Zuckergehalt.
- Zusatz zu Kakao als Säureregulator
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) als Aromaverstärker.
- Schnelltrocknung von Rosinen: Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter.
- Ausgangsprodukt für andere Kaliumverbindungen.
- Zum Entfernen von Krusten aus Töpfen: 1 Esslöffel auf die Kruste im Topf geben, über Nacht stehen lassen und am nächsten Tag mit einer Tasse Wasser aufkochen; die Rückstände lösen sich flockig vom Topfboden.
- Trennmittel für Gipsabgüsse (Bildhauerei)
- Elektrolytbestandteil in Schmelzkarbonatbrennstoffzellen
- Tabakzusatzstoff für Schnupftabak (in Deutschland laut Tabakverordnung)
- Zusatzstoff für die Einnahme von bestimmten Suchtmitteln
- Zusatzstoff in manchen Handwasch-Flüssigseifen
- umweltfreundliches Auftaumittel (anstelle von Auftausalz) bei Glatteis auf Straßen und Gehwegen
- Aufgrund des stets enthaltenen radioaktiven Kalium-40 kann Pottasche für Schülerversuche zur Radioaktivität verwendet werden
- Viele Jahrhunderte lang wurde in Europa das Kaliumcarbonat in Form der Buchenasche zum Bauchen von Kleidung und anderen Textilien aus Leinen und später auch aus Baumwolle verwendet. Die Asche wird dabei in Säckchen gefüllt und einem mit geschichteter Wäsche gefüllten Holzfass beigegeben. Durch Überschütten des Säckchens mit heißem Wasser wurde eine Lauge frei, die reinigend und leicht bleichend gewirkt hat. Mit Wasser wurde die Lauge danach am Waschbrunnen oder am Fluss ausgewaschen. Das Aufkommen von Kernseife und später künstlichen Reinigungsstoffen zu Anfang des 20. Jahrhunderts machte diese Methode obsolet.
- Bestandteil von Feuerlöschmitteln
Soda-Pottasche-Aufschluss
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure oder amphotere) Oxide, Silicate und Silberhalogenide verwendet; der Aufschluss findet in einer Na2CO3/K2CO3-Schmelze statt. ZrO2, Zr3(PO4)4, Al2O3, Cr2O3 und Fe2O3 werden nur teilweise gelöst. Für diesen Schmelzeaufschluss verwendet man Soda und Pottasche im Gemisch, weil damit eine Schmelzpunkterniedrigung gegenüber reinen Salzen zu erhalten ist (Eutektisches Gemisch). Zudem drängt der enorme Carbonatüberschuss das Reaktionsgleichgewicht auf die Produktseite.
Ein Beispiel für Sulfate:


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025
