
Natriumcarbonat
| |||||||
| Toxikologische Daten | 4090 mg/kg (LD50, Ratte, oral)[3] | ||||||
Natriumcarbonat (fachsprachlich) oder Natriumkarbonat (Na2CO3), wasserfrei auch calcinierte Soda genannt, ist ein Salz der Kohlensäure. Als Lebensmittelzusatzstoff trägt es das Kürzel E 500.
Modifikationen
Natriumcarbonat ist polymorph, kristallisiert also in Abhängigkeit von Druck und Temperatur bei gleicher chemischer Zusammensetzung in verschiedenen Kristallsystemen, die wasserfrei sein, aber auch Kristallwasser (Hydrat) enthalten können.
- Wasserfrei, Na2CO3
- Bekannt als Mineral Natrit oder unter der Bezeichnung calcinierte Soda, weiße Substanz mit einem Schmelzpunkt von 853 °C und einer Dichte von 2,51 g/cm3. Bildet sich bei Temperaturen größer 107 °C.
- Monohydrat, Na2CO3 · H2O
- Bekannt als Mineral Thermonatrit, bildet sich bei Temperaturen > 35,4 °C aus dem Heptahydrat.
- Heptahydrat, Na2CO3 · 7 H2O
- Bildet sich bei Temperaturen oberhalb 32,5 °C aus dem Decahydrat.
- Decahydrat, Na2CO3 · 10 H2O
- Bekannt als Mineral Soda oder unter der Bezeichnung Kristallsoda, kristallisiert bei unter 32,5 °C aus gesättigten Natriumcarbonat-Lösungen aus (Dichte 1,45 g/cm3).
Darüber hinaus findet sich Natriumcarbonat zusammen mit Natriumhydrogen- beziehungsweise Calciumcarbonat in der Natur in folgenden Mineralen:
- Dihydrat, Na2Ca(CO3)2 · 2 H2O
- Bekannt als Mineral Pirssonit.
- Pentahydrat, Na2Ca(CO3)2 · 5 H2O
- Bekannt als Mineral Gaylussit oder unter der Bezeichnung Natrocalcit.
- Hydrogencarbonat, Na(HCO3) · Na2CO3 · 2 H2O
- Bekannt als Mineral Trona.
| Strukturformel | ||
|---|---|---|

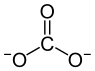
![\mathrm{ \ \!\ \Biggr]}](/png/2c6110b020ae0c3cfe64f3748f9aea9a.png) | ||
| Allgemeines | ||
| Name | Natriumcarbonat (wasserfrei) | |
| Andere Namen |
| |
| Summenformel | Na2CO3 | |
| CAS-Nummer | ||
| EG-Nummer | 207-838-8 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Kurzbeschreibung | farbloses kristallines Pulver | |
| Eigenschaften | ||
| Molare Masse | 105,99 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 2,53 g/cm3 | |
| Schmelzpunkt | 851 °C | |
| Siedepunkt | 1600 °C (Zersetzung) | |
| Löslichkeit | gut in Wasser (217 g/l bei 20 °C) | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −1130,7 kJ/mol | |
Eigenschaften
Als Natriumsalz der schwachen Kohlensäure reagiert es mit stärkeren Säuren unter Bildung von Kohlenstoffdioxid (Aufschäumen). In Wasser löst Natriumcarbonat sich unter Wärmeentwicklung (Hydratationswärme). Eine stark alkalische Lösung entsteht, da das Carbonatanion als Base mit einem Proton aus dem Dissoziationsgleichgewicht des Lösungsmittels Wasser zum Hydrogencarbonation (HCO3−) reagiert und eine entsprechend hohe Hydroxidionenkonzentration entsteht:
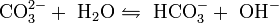
- Dissoziationsgleichgewicht des Carbonations in Wasser.
Vor der Verfügbarkeit größerer Mengen von Natriumhydroxid war Natriumcarbonat damit die wichtigste Base, da es sich in Wasser gelöst verhält wie eine Mischung aus Natriumhydrogencarbonat und Natriumhydroxid: Eine Lösung von 50 g Natriumcarbonat pro Liter Wasser weist einen pH-Wert von 11,5 auf.
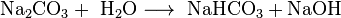
- Reaktion von Natriumcarbonat und Wasser.
Die Standardbildungsenthalpie von Natriumcarbonat beträgt ΔfH0298 = −1131,7 kJ/mol, die Freie Standardbildungsenthalpie ΔG0298 = −1048,4 kJ·mol−1, und die molare Standardentropie S0298 = 136,1 J·K−1 ·mol−1.
Vorkommen

Es kommt in Sodaseen in Ägypten, der Türkei (Van-See), Ostafrika (z.B. Lake Natron und andere Seen des Ostafrikanischen Grabens), Kalifornien, Mexiko und als Trona (Na(HCO3) · Na2CO3 · 2H2O) in Wyoming (USA), Mexiko, Ostafrika und in der südlichen Sahara vor.
Gewinnung und Herstellung

- Durch Abbau natürlich vorkommender natriumcarbonathaltiger Minerale (s.o.): Wegen ihrer vielfältigen Verunreinigungen werden die Ausgangsminerale vor dem Transport und der Weiterverwendung umkristallisiert und anschließend in gereinigte, kristallwasserfreie Soda überführt (z.B. mit Hilfe des Trona-Verfahrens, benannt nach dem gleichnamigen Ausgangsmineral).
- Nach dem Leblanc-Verfahren (seit 1791): Technisches Natriumchlorid wird mit heißer Schwefelsäure zu Chlorwasserstoffgas und Natriumsulfat umgesetzt, das als „Salzkuchen“ zurückbleibt und im nächsten Schritt mit Calciumcarbonat und Kohle zu Natriumcarbonat, Kohlenstoffdioxid und Calciumsulfid reagiert. Nachdem dieses Verfahren zur Herstellung von Natriumcarbonat durch das Solvay-Verfahren abgelöst wurde, wird es heute nicht mehr eingesetzt, besitzt jedoch weiter große historische Bedeutung, da mit ihm die Entwicklung der chemischen Großindustrie begann.

- Nach dem Solvay-Verfahren (auch Ammoniak-Soda-Verfahren, seit 1863): Einleiten von Ammoniak und Kohlendioxid in eine gesättigte Natriumchlorid-Lösung und Erhitzen des so entstandenen Natriumhydrogencarbonates im Drehrohrofen.
- Das entstandene Kohlenstoffdioxid sowie der Ammoniak aus der Reaktion des Ammoniumchlorides mit Calciumoxid oder Calciumhydroxid werden dabei wieder in den Prozess zurückgeführt, was diesen sehr wirtschaftlich (und so zu einem der ersten in großem Stil praktizierten chemischen Kreisprozesse) machte.
- Einleiten von Kohlenstoffdioxid in Natronlauge (technisch unbedeutend):
Lagerung

Kristallsoda muss gut verschlossen in feuchten Räumen gelagert werden, da sie an trockener Luft Kristallwasser abgibt und in ein weißes Pulver zerfällt.
Umgekehrt muss man calcinierte, d.h. wasserfreie Soda in trockenen Räumen aufbewahren, da sie – ohne dadurch sofort feucht auszusehen – leicht Feuchtigkeit aus der Luft aufnimmt und mit dieser in das Monohydrat Na2CO3 · H2O übergeht (Hygroskopie).
Verwendung
Natriumcarbonat wird seit langer Zeit durch den Menschen genutzt. Schon die alten Ägypter setzten es zum Mumifizieren ein. Ebenso fand es seit dem Altertum Verwendung als Reinigungsmittel und bei der Glasherstellung. Heute wird Natriumcarbonat von fast allen Industriezweigen eingesetzt und ist damit eines der vielseitigsten chemischen Produkte.
Weltweit wurden 1997 ca. 39 Millionen Tonnen Soda produziert. In Deutschland betrug das Marktvolumen 1999 ca. 2,4 Millionen Tonnen. Der größte Anteil an Soda wird dabei von den folgenden fünf Industriebranchen verbraucht:
- Die Glasindustrie verwendet Soda als Rohstoff für ihre Glasschmelzen und ist damit der größte Sodaverbraucher. Soda fungiert dabei als Flussmittel, das in der erstarrenden Glasschmelze deren Auskristallisieren verhindert und dadurch das Glas amorph hält. Der Anteil an Soda bestimmt dabei die Fließfähigkeit der Schmelze.
- Die chemische Industrie setzt Soda zur Herstellung von Bleichmitteln, Borax, Chromaten wie Natriumchromat und Natriumdichromat, Farben, Füllstoffen, Gerbereihilfen, Industriereinigern, Kryolith, Leim- und Klebstoffen, Metallcarbonaten, Natronsalpeter, Perborat, Natriumphosphaten wie zum Beispiel Pentanatriumtriphosphat, Silikaten (Wassergläser) wie zum Beispiel Natriummetasilikat-Pentahydrat und Natriumorthosilikat, Sulfit, Ultramarinfarben u.a. Chemikalien ein.
- In der Eisenhüttenindustrie wird Soda zur Entschwefelung von Roheisen, Gusseisen und Stahl sowie als Flotations- und Flussmittel verwendet.
- In der Waschmittel- und Seifenindustrie werden mit Soda Grobwaschmittel und andere Reinigungsmittel hergestellt sowie Fette verseift. Früher wurde Soda zu diesem Zweck kaustifiziert, d.h. mit Calciumoxid oder -hydroxid zu Ätznatron umgesetzt.
- In der Papier- und Zellstoffindustrie dient Soda sowohl zum Aufschluss, zur Neutralisation, zum Reinigen und Bleichen als auch zur Aufarbeitung von Altpapier.
- Weitere Anwendungen:
- Lederindustrie
- Wasserreinigung
- Innere Speisewasseraufbereitung bei Dampfkesseln
- Backwarenherstellung
- Keramik- und Emailleherstellung
- Textilindustrie
- Rauchgasentschwefelung
- Urtitersubstanz nach Arzneibuch
- Entgiftung von Nervenkampfstoffen
- pH-Wert-Anhebung in Schwimmbädern ("Plus-Granulat" ist meist Natriumcarbonat)
- Entwicklung von Schwarzweißfilmen als Bestandteil des Entwicklers Caffenol
Einzelnachweise
- ↑ Eintrag zu
 Sodium carbonate im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA),
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Sodium carbonate im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA),
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Eintrag zu
 Natriumcarbonat in der
GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Natriumcarbonat in der
GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Datenblatt
 Natriumcarbonat bei Merck.
Natriumcarbonat bei Merck.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 26.08. 2025
