Harnstoff
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| LD50 |
8471 mg/kg-1 (Maus, peroral) | ||||||||
Harnstoff (lateinisch und englisch urea), chemisch Kohlensäurediamid, ist eine organische Verbindung, die von vielen Lebewesen als ein Endprodukt des Stoffwechsels von Stickstoffverbindungen (z.B. Aminosäuren) im sogenannten Harnstoffzyklus produziert und im Urin ausgeschieden wird. Reiner Harnstoff ist ein weißer, kristalliner, ungiftiger und hygienisch unbedenklicher Feststoff, der nicht mit Harnsäure zu verwechseln ist.
Geschichte

Harnstoff wurde 1828 von Friedrich Wöhler erstmals durch Reaktion von Kaliumcyanat und Ammoniumsulfat synthetisiert.
Harnstoff gilt als die erste aus anorganischen Ausgangsstoffen synthetisierte organische Verbindung. Das widersprach der damals verbreiteten Vorstellung, dass organische Substanzen grundsätzlich nur von Lebewesen durch die so genannte "vis vitalis" (Lebenskraft) hergestellt werden könnten. Genau genommen hat Wöhler bereits 1824 durch Hydrolyse von Dicyan zu Oxalsäure den Nachweis erbracht, dass es für die Synthese organischer Moleküle nicht der "Lebenskraft" bedarf.
In Goethes Humunkulus findet die Harnstoffsynthese prominente literarische Verarbeitung.
Die großtechnische Realisierung dieses Verfahrens gelang Carl Bosch im Jahr 1922, nachdem Ammoniak in großen Mengen durch das Haber-Bosch-Verfahren sowie die erforderliche Hochdrucktechnik zur Verfügung stand. Mit dem weltweiten Bau von Haber-Bosch-Anlagen nach dem Zweiten Weltkrieg stieg die Produktion von Harnstoff parallel zur Produktion von Ammoniak rasch an.
| Strukturformel | ||
|---|---|---|
 | ||
| Allgemeines | ||
| Name | Harnstoff | |
| Andere Namen |
| |
| Summenformel | CH4N2O | |
| CAS-Nummer | ||
| EG-Nummer | 200-315-5 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| ATC-Code | ||
| Kurzbeschreibung | farb- und geruchloser, kristalliner Feststoff | |
| Eigenschaften | ||
| Molare Masse | 60,06 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,32 g/cm3 | |
| Schmelzpunkt | 132,5-134,5 °C (Zersetzung) | |
| Dampfdruck | 0,2 Pa (75 °C) | |
| pKs-Wert | ||
| Löslichkeit |
sehr gut in Wasser:
| |
Eigenschaften
Physikalische Eigenschaften
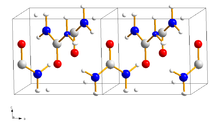
_ Sauerstoff, _ Stickstoff,
_ Kohlenstoff, _ Wasserstoff
Harnstoff ist unter Standardbedingungen ein farbloser kristalliner Feststoff mit einer Dichte von 1,32 g/cm3. Er schmilzt im Bereich von 132,5 bis 134,5 °C unter Zersetzung. Der Dampfdruck bei 75 °C beträgt 0,2 Pascal. Harnstoff löst sich sehr gut in Wasser und anderen polaren Lösungsmitteln; dabei löst sich ein Gramm Harnstoff in 1,5 ml Wasser, 10 ml Ethanol, 6 ml Methanol oder 2 ml Glycerin.
Harnstoff kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P421m (Raumgruppen-Nr. 113) mit den Gitterparametern a = 564,6 pm, c = 470 pm und einem Verhältnis von a : c = 1 : 0,833. Er entwickelt farblose bis blass-gelbe oder blass-braune, nadelförmige Kristalle. Fester Harnstoff weist am Sauerstoffatom zwei N–H–O-Wasserstoffbrückenbindungen auf, die Distanz zwischen den Sauerstoff- und den Wasserstoffatomen beträgt 299 Pikometer und 304 Pikometer. Unter hohem Druck brechen die vorhandenen Wasserstoffbrückenbindungen unter anschließender Ausbildung neuer Bindungen. Ab einem Druck von 4800 bar bildet sich eine orthorhombische Phase mit der Raumgruppe P212121 (Raumgruppen-Nr. 19).
Die Kristallstruktur besteht aus Bändern in Helixform, die organische Verbindungen als Gastmoleküle einlagern können. In diesen Clathraten werden die organischen Gastmoleküle in den Kanälen, die durch interpenetrierende Helices von Wasserstoff-gebundenen Harnstoffmolekülen gebildet werden, gehalten. Dieses Verhalten kann zur Trennung von linearen und verzweigten Kohlenwasserstoffgemischen verwendet werden, beispielsweise in der Harnstoff-Extraktiv-Kristallisation.
Chemische Eigenschaften
- Harnstoff löst sich leicht in Wasser und Ethanol, aber nicht in Diethylether oder Benzol. Die wässrige Lösung reagiert neutral. Mit Säuren bildet sich die protonierte Form [NH2C(OH)NH2]+. Die Harnstoffsalze der Salpetersäure sind Explosivstoffe. Beim Erhitzen der wässrigen Lösung mit Säuren zerfällt Harnstoff in Kohlenstoffdioxid und Ammoniumsalze, beim Erhitzen mit Laugen in Carbonate und Ammoniak.
- Harnstoff kondensiert beim Erhitzen über den Schmelzpunkt unter Abspaltung von Ammoniak zunächst zu Isocyansäure, die mit Harnstoff weiter zu Biuret reagiert:
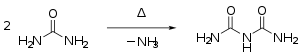
Synthese von Biuret
Bei höheren Temperaturen bilden sich weitere Kondensationsprodukte wie Triuret, Guanidin und Melamin.
Diese Transamidierungen sind wichtige Reaktionen zur generellen Darstellung von Harnstoffderivaten:
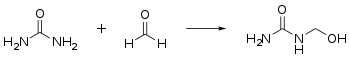
- Mit Formaldehyd reagiert Harnstoff in einer Additionsreaktion zu Methylolharnstoffen, die Hydroxymethylgruppen aufweisen:
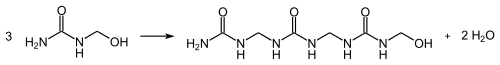
Diese reagieren in einer Kondensationsreaktion unter Freisetzung von Wasser und Ausbildung von Methylengruppen zu Harnstoffharzen:
- Harnstoff bildet mit Wasserstoffperoxid ein Wasserstoffperoxid-Harnstoff-Addukt, das Carbamidperoxid. Dies ist ein wasserlösliches kristallines Addukt, das sich bei der Umkristallisation von Harnstoff mit konzentrierter Wasserstoffperoxid-Lösung bildet. Es enthält etwa 35 % Wasserstoffperoxid.
Der Wasserstoff lässt sich durch verschiedene Reaktionen teilweise oder ganz durch andere Substituenten ersetzen. Mit Benzoylchloriden etwa entstehen Imide wie Benzoylharnstoffe, durch Reaktion mit Sulfonylchlorid entstehen Sulfonylharnstoffe.
Durch Erhitzen auf etwa 200 bis 300 °C bildet sich Cyanursäure.
- Durch Einleiten von Chlor in eine 20%ige Harnstofflösung und anschließender Zugabe von 20%iger Natronlauge entsteht Hydrazin in 50%iger Ausbeute in einer Hofmann-Umlagerung.
- Harnstoff zerfällt bei sehr hohen Temperaturen zu Ammoniak und Kohlendioxid
Das dabei entstehende Ammoniak wird im SNR-Verfahren genutzt, um die in Abgasen von Kraftwerken und Verbrennungsmotoren enthaltenen Stickoxide zum elementaren Stickstoff zu reduzieren
Molekulare Eigenschaften[Bearbeiten | Quelltext bearbeiten]
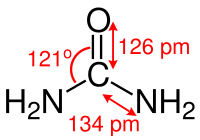
Das Kohlenstoff-Atom des Harnstoffmoleküls ist trigonal planar koordiniert (grob: sp2-hybridisiert), die Kohlenstoff-Stickstoff-Bindungen weisen einen signifikanten Doppelbindungscharakter auf und sind, verglichen mit den Kohlenstoff-Stickstoff-Bindungen in Alkylaminen, um etwa 10 Pikometer kürzer. Der Atomabstand zwischen Stickstoff und Wasserstoff beträgt 105 Pikometer, der Abstand zwischen Stickstoff und Kohlenstoff beträgt 134 Pikometer und der Abstand zwischen Kohlenstoff und Sauerstoff beträgt 126 Pikometer. Der N–C–O-Winkel beträgt 121°. Das Molekül weist insgesamt C2v-Symmetrie auf.
Die Streckschwingung νN–H liegt im infraroten Bereich des Spektrums bei einer Wellenzahl von 3396 cm−1 und damit höher als bei Ammoniak, das eine Wellenzahl von 3372 cm−1 aufweist. Die νC=O-Streckschwingung liegt bei 1687 cm−1 und weist auf eine Resonanz zwischen einer Carbonyl- und Alkoholatstruktur hin. Die νC-N-Streckschwingung liegt bei 1465 cm−1.
Physiologische Bedeutung
Harnstoff wird im Protein- und Aminosäure-Stoffwechsel gebildet. Bei Säugetieren, Schildkröten, einigen Fischen und bei adulten Amphibien stellt er die wichtigste Ausscheidungsform des insbesondere in Proteinen enthaltenen Stickstoffs dar. Vögel und die meisten Reptilien bilden stattdessen Harnsäure; Kaulquappen, die meisten Fischarten und die anderen Wassertiere scheiden den Stickstoff als Ammoniak aus.
Ammoniak entsteht beim Aminosäureabbau und wirkt in entsprechend hohen Konzentrationen giftig auf Zellen. Um einem Anwachsen der Ammoniakkonzentration entgegenzuwirken, wird dieses über den Harnstoffzyklus in den ungiftigen Harnstoff umgewandelt und über die Nieren ausgeschieden.
Erkrankungen wie das akute oder chronische Nierenversagen, sowie eine diabetisch eingeschränkte Nierenfunktion, können zu erhöhten Harnstoffwerten im Serum/Plasma führen (Normalwert: 10-50 mg/dl).
Störungen und Besonderheiten
Eine hohe Proteinzufuhr führt auch schon bei normaler Nierenfunktion zu erhöhten Harnstoffwerten, was ihn zu einem schlechten Nierenparameter macht. Bei (prä-)terminaler Niereninsuffizienz ist die Harnstoffkonzentration im Serum aber besser geeignet, den Schweregrad der Urämie abzuschätzen, als die Serumkreatininkonzentration.
Anwendungen
Aufgrund seines hohen Stickstoffgehaltes von 46,62 % ist Harnstoff weltweit das bedeutendste Stickstoffdüngemittel.
Harnstoff wird wegen seiner hohen Wasserbindungsfähigkeit darüber hinaus häufig als Feuchtigkeitsfaktor in Kosmetika eingesetzt. In der Pharmazie kennt man Harnstoff als Keratolytikum. Diese Eigenschaft macht man sich in verschiedenen Rezepturen zunutze. Beispielsweise wirkt er hoch konzentriert (40 %) in Pasten zusammen mit einem Antipilzmittel (Antimykotikum) gegen Nagelpilz (Onychomykose), wobei der Harnstoff den Nagel so weich macht, dass sich die infizierte Nagelsubstanz Stück für Stück abtragen lässt. Weiter dient er als Feuchtigkeitsspender in Salben zur Bekämpfung von atopischen Ekzemen und Lichenerkrankungen.
Zigarettenhersteller mischen Harnstoff dem Tabak bei, damit das Nikotin durch Erhöhung des pH-Wertes in der Lunge besser aufgenommen werden kann. So wird die Wirkung vermeintlich leichter Zigaretten verstärkt.
Harnstoff kann auch als Streusalz-Ersatz eingesetzt werden, was aber wegen seines höheren Preises nicht wirtschaftlich ist. In Wien ist sein diesbezüglicher Einsatz — der zur Überdüngung des Bodens führt — verboten.
Harnstoff wird zur Reduktion von Stickoxiden im Abgas von Kraftwerken und Verbrennungsmotoren verwendet. In Kraftwerken wird — vornehmlich bei kleineren Anlagen — das SNCR-Verfahren (selektive nicht-katalytische Reduktion) angewandt. Beim sogenannten SCR-Verfahren (Selektive katalytische Reduktion), das in Kraftwerken und in zunehmendem Maß auch in der Fahrzeugtechnik eingesetzt wird, wird Harnstoff oder Ammoniakin den heißen Abgasstrom eingespritzt. Der Harnstoff zersetzt sich zu Ammoniak, das in einem nachgeschalteten Katalysator die Stickoxide reduziert. In der Kraftfahrzeugtechnik wird eine wässrige Lösung mit 32,5 % Harnstoffanteil verwendet, die unter dem Handelsnamen AdBlue bekannt ist. Der Verbrauch an Harnstofflösung beträgt etwa 2 bis 8% des Treibstoffverbrauchs.
Harnstoff wird Lebensmitteln als Stabilisator zugesetzt. In der EU ist er als Lebensmittelzusatzstoff mit der Bezeichnung E 927b ausschließlich für Kaugummi ohne Zuckerzusatz zugelassen.
In der Milchviehfütterung spielt Harnstoff eine Rolle als Proteinlieferant.
Der Zusatz von Harnstoff in höheren Konzentrationen zu wässrigen Lösungen führt zu einer Denaturierung von Proteinen, Harnstoff wirkt daher als Denaturierungsmittel bzw. als chaotrope Verbindung. Kleine Konzentrationen von Harnstoff können jedoch die gegenteilige Wirkung entfalten, nämlich den hydrophoben Effekt verstärken und somit die Proteinstruktur stabilisieren.
Industrielle Herstellung
Harnstoff wird in großen Mengen industriell hergestellt (2012: rund 184 Mio. t weltweit). Die erste Produktionsanlage wurde 1922 von der BASF in Betrieb genommen. Das in einem Hochdruckreaktor im ersten Schritt bei 150 bar gebildete Ammoniumcarbamat wurde anschließend in Zersetzern thermisch in Harnstoff gespaltet. überschüssiges Ammoniak wurde zur Herstellung von Ammoniumsulfat und Ammoniumnitrat als Dünger verwendet. Ende der 1920er Jahre wurde das Verfahren verbessert und überschüssiges Ammoniak in den Produktionsprozess zurückgeführt. Hieraus entwickelten sich verschiedene Totalkreislaufverfahren. Allen Verfahren gemeinsam ist, dass das in einem Reaktor bei hohem Druck exotherm gebildete Ammoniumcarbamat in anschließenden Zersetzerstufen bei niedrigem Druck endotherm in Harnstoff umgewandelt wird und überschussgase wieder in den Reaktor zurückgeführt werden, wobei man hierzu heute wirtschaftliche Strippingverfahren einsetzt.
In Ländern mit großen Erdgasvorkommen, die früher oft einfach abgefackelt wurden, wird Erdgas heute in Harnstoff umgewandelt. Dazu dienen große Anlagen, die aus Erdgas, Luft und Wasser in den Prozessschritten Wasserstoffherstellung → Ammoniakherstellung→ Harnstoffsynthese, schließlich Harnstoff herstellen. (Streng genommen werden die genannten Edukte in ein Prozessgas bestehend aus H2, N2 und CO2 umgesetzt, aus dem das CO2 entfernt wird. Wasserstoff und Stickstoff werden dann in Ammoniak umgewandelt. Reiner Wasserstoff kommt in dieser Kette nicht vor). Das für die Ammoniakherstellung abgetrennte CO2 wird nur zu 2/3 vom Harnstoff gebunden. Der zunächst in Lösung anfallende Harnstoff wird in Granulat umgewandelt und sackweise oder lose vertrieben. Die größten Anlagen der Welt produzieren ca. 4.000 t Harnstoff am Tag.
Reaktionsgleichungen:
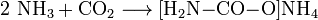
- Ammoniak und Kohlenstoffdioxid reagieren exotherm zu Ammoniumcarbamat.
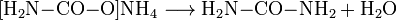
- Ammoniumcarbamat reagiert endotherm zu Harnstoff und Wasser.
Eine industrielle Verwendungsmöglichkeit von Harnstoff ist die Herstellung von Melamin, das z.B. mit Formaldehyd zu Kunstharzen verarbeitet wird, und von Harnstoff-Formaldehyd-Harzen (Harnstoffharz, so genannte UF-Harze), die z.B. zur Produktion von Spanplatten eingesetzt werden. Ansonsten dient Harnstoff überwiegend als Stickstoffdünger oder als NOx-Reduktionsmittel beim SNCR-Verfahren.
Harnstoff als Mineral
Harnstoff konnte 1973 als natürliches Sekundärmineral bei Toppin Hill am Lake Rason (Westaustralien) gefunden werden. Es wurde von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt. Diese führt es gemäß der Systematik der Minerale nach Strunz (9. Auflage) als "Diverse organische Verbindungen" unter der System-Nr. "10.CA.35". Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Mineral unter der System-Nr. "50.4.6.1". Harnstoff kristallisiert im tetragonalen Kristallsystem. Es entwickelt farblose bis blass-gelbe oder blass-braune, nadelförmige Kristalle.
Harnstoff ist Bestandteil des Urins bzw. des Kots von Vögeln und Fledermäusen und daher Bestandteil in Guano und Fledermausguano (Chiropterit). Als Mineral ist Harnstoff nicht stabil und kann nur unter ariden Bedingungen gebildet werden.

Basierend auf einem Artikel in ![]() Wikipedia.de
Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 13.12. 2024