
Kaliumdichromat
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR); zulassungspflichtig | ||||||||||
| MAK |
| ||||||||||
| Toxikologische Daten | |||||||||||
Kaliumdichromat, K2Cr2O7, ist das Kaliumsalz der in freier Form instabilen Dichromsäure. Andere Bezeichnungen sind: Kaliumbichromat, Doppeltchromsaures Kalium, Pyrochromsaures Kalium, Chromkali; englisch: Potassium dichromate.
| Strukturformel | |
|---|---|
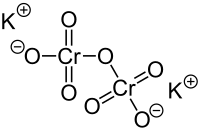
| |
| Allgemeines | |
| Name | Kaliumdichromat |
| Andere Namen |
|
| Summenformel | K2Cr2O7 |
| Kurzbeschreibung | orangerote, nicht hygroskopische, trikline Tafeln |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7778-50-9 |
| EG-Nummer | 231-906-6 |
| ECHA-InfoCard | 100.029.005 |
| PubChem | 24502 |
| Eigenschaften | |
| Molare Masse | 294,19 g/mol |
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt | 398 °C (α-Modifikation) |
| Siedepunkt | thermische Zersetzung: > 400 °C |
| Löslichkeit | |
Historisches
Im Jahre 1856 wurde von W. H. Perkin bei der Oxidation von unreinem Anilin mit Kaliumdichromat der erste künstlich hergestellte Farbstoff, das Mauvein (auch Perkinviolett), entdeckt.
Vorkommen
Kaliumdichromat kommt natürlich in Form des Minerals Lópezit vor.
Gewinnung und Darstellung
Die technische Herstellung erfolgt durch Zusammenschmelzen von Chromeisenstein, Kaliumcarbonat (Pottasche) und Calciumcarbonat und Oxidation durch eingeblasene Luft. Es entsteht dabei zunächst das gelbe Kaliumchromat K2CrO4, welches ausgelaugt wird und nach Säurezugabe und Umkristallisation Kaliumdichromat liefert.
Im Labormaßstab kann Kaliumdichromat durch Zusammenschmelzen von Kaliumnitrat und Chrom(III)-oxid gewonnen werden.
- Chromoxid reagiert mit Kaliumnitrat zu Kaliumdichromat und Stickstoffmonoxid
Ebenfalls möglich ist die Darstellung durch Reaktion einer Natriumdichromat-Lösung mit Kaliumchlorid:
Eigenschaften
Kaliumdichromat bildet leuchtend orangerote Kristalle ohne Kristallwasser, die einen Schmelzpunkt von 397 °C haben und sich ab 500 °C unter Sauerstoffabgabe zu Kaliumchromat K2CrO4 und Chrom(III)-oxid Cr2O3 zersetzen.
Kaliumdichromat ist ein starkes Oxidationsmittel, besonders in saurer Lösung. In alkalischem Milieu liegt hauptsächlich das gelbe Chromat CrO42− vor, welches weit weniger stark oxidierend wirkt. So schlägt bei Zusatz von Kalilauge die orangerote Farbe einer Kaliumdichromat-Lösung durch Entstehung von Kaliumchromat in Hellgelb um:
Kaliumdichromat ist gut wasserlöslich. Das Dichromat-Anion Cr2O72− steht in wässriger Lösung im Gleichgewicht mit HCrO4−, CrO42−. Daher bilden sich mit Barium-, Blei- und Silberionen (Ba2+, Pb2+, Ag+) gelbe schwerlösliche Chromate und nicht Dichromate. Viele Säureanionen reagieren zu weiteren Anionenkomplexen, beispielsweise entsteht in Salzsäure CrO3Cl−, welches als Kaliumsalz auskristallisiert werden kann. Ähnlich reagieren auch Bromid und Iodid, denn obwohl (thermodynamisch) eigentlich die Oxidation zu den elementaren Halogenen stattfinden müsste, wird die Oxidation durch die geringe Reaktionsgeschwindigkeit verhindert (kinetische Hemmung). Mit Schwefelsäure werden primäre Alkohole zu Aldehyden bzw. Carbonsäuren oxidiert, wobei das Dichromat in grünes, dreiwertiges Chromsulfat übergeht. Das Chrom im Kaliumdichromat besitzt die Oxidationszahl +VI.
Die Verbindung hat gewöhnlich eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2) und den Gitterkonstanten a = 13,367, b = 7,376, c = 7,445 Å, α = 90,75°, β = 96,21°, γ = 97,96° mit vier K2Cr2O7-Einheiten pro Zelle. Die monokline, bei Zimmertemperatur metastabile Modifikation β-K2Cr2O7 (Raumgruppe C2/c (Raumgruppen-Nr. 15)) wurde zuerst 1960 von Ulrich Klement und Georg Maria Schwab neben einer Hochtemperaturform mit der monoklinen Raumgruppe P21/n (Nr. 14, Stellung 2). Einige Quellen geben auch noch eine metastabile Zwischenstruktur an. Die monokline Form wandelt sich ab 258 °C in die trikline Form um.
Verwendung
Im Labor wird Kaliumdichromat wegen der guten Lagerfähigkeit und Wägbarkeit als verbreitetes Oxidationsmittel, Reagenz (Nachweis von Wasserstoffperoxid durch Blaufärbung) und Urtitersubstanz eingesetzt.
In der Technik wird es in der Gerberei, der Galvanoplastik und zur Herstellung von Chromschwefelsäure benutzt. In Zündköpfen für Streichhölzer wird es als Zusatz verwendet um die Brennrate zu regulieren. In der Analogfotografie und den Edeldruckverfahren wird Kaliumdichromat als lichtempfindliche, Kolloide gerbende Substanz verwendet, besonders im Lichtdruck und Gummidruck. In der Neurohistologie wurde von Camillo Golgi eine Methode zum Anfärben einzelner Nerven und Neurone entwickelt. Als „Schwarze Reaktion“ bekannt, werden so Nervenzellen bis in feinste Strukturen mit Hilfe von Kaliumdichromat und Silbernitrat gefärbt. Einwegtests zur Bestimmung von Alkohol im Atem enthielten früher Kaliumdichromat, weshalb sie als Sondermüll entsorgt werden sollten. Die Herstellung der kaliumdichromathaltigen Alcotest-Röhrchen bei der Firma Dräger wurde nach 53 Produktionsjahren Ende 2016 eingestellt.
An Schulen in Deutschland sind sowohl die Verwendung als auch die Aufbewahrung streng reglementiert (Stoffliste zur DGUV-Regel CAS-Nummer 7778- 50-9).
Kaliumdichromat wird häufig für die Messung des chemischen Sauerstoffbedarfs (CSB) einer Wasserprobe in Kläranlagen verwendet. Entsprechende Zulassungsanträge bei der europäischen Chemikalienagentur (ECHA) nach der Aufnahme der Verbindung in Anhang XIV der REACH-Verordnung wurden 2015 gestellt.
Sicherheitshinweise und gesetzliche Regelungen
Kaliumdichromat wirkt lokal und systemisch stark toxisch. Es reizt die Haut, Atmungsorgane und die Augen und zählt zu den wichtigsten Kontaktallergenen. Obwohl der Stoff bis vor wenigen Jahren noch als Xi (reizend) eingestuft war, ist Kaliumdichromat heute als sehr giftig, brandfördernd und umweltgefährlich eingestuft.
Kaliumdichromat wurde im Juni 2010 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B), mutagen (Muta. 1B) und reproduktionstoxisch (Reprod. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen. Im April 2013 wurde Kaliumdichromat danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. September 2017 aufgenommen. Als Chrom(VI)-Verbindung unterliegt Kaliumchromat außerdem den Beschränkungen im Anhang XVII, Nummer 47 und 72 der REACH-Verordnung (in Deutschland umgesetzt durch die Chemikalien-Verbotsverordnung).
Bei wiederholtem Hautkontakt tritt Sensibilisierung ein und es können Allergien entstehen. In einer Hochrechnung für die Gesamtbevölkerung Deutschlands mit best-case-, medium-case- und worst-case-Annahmen wurde unter Zugrundelegung eines „medium case scenario“ die Quote der Sensibilisierungen für Chrom (VI) (Kaliumdichromat) mit 0,6 % veranschlagt. Bei einer Bevölkerungszahl von 82 Millionen entspricht dies etwa 514.000 Fällen. Durch sein Vorkommen in Zement, war die Verbindung früher häufig Auslöser von Ekzemen, die als Maurerkrätze, Maurerekzem, Chromekzem oder Zementekzem heute allgemein als Chromatallergie bezeichnet werden. Durch Maßnahmen zur Reduktion von Chrom(VI) im Zement (Zugabe von Eisen(II)-sulfat) ist die Anzahl der Sensibilisierungen rückläufig. Chromallergien sind jedoch häufig chronisch, was durch das Vorkommen von Kaliumdichromat in fast allen Lederprodukten problematisch ist.
Mit organischen, brennbaren Verbindungen, Reduktionsmitteln, konzentrierter Schwefelsäure, Metallen in Pulverform (besonders: Magnesium, Eisen) sind heftige Reaktionen bis zur Selbstentzündung oder Explosion möglich. Kaliumdichromat ist zwar nicht brennbar, aber brandfördernd. Der Stoff sollte im Originalbehälter zur Problemmüllsammlung oder zu einem Entsorgungsunternehmen gebracht werden. Die Entsorgung von Kaliumdichromat kann mit Eisensulfat erfolgen, wobei es zu Cr3+ reduziert wird, welches ausgefällt als unlösliches Chromhydroxid wesentlich weniger gefährlich ist. Durch Chrom und Chromate ausgelöste Krankheiten nach beruflicher Exposition (zum Beispiel Ekzeme oder Bronchialkarzinome bei Fliesenlegern, Maurern und Bergleuten) sind melde- und entschädigungspflichtige Berufskrankheiten (BK 1103).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.08. 2025




