Nitrogruppe
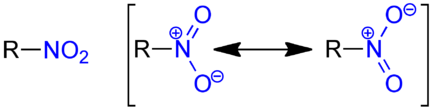
Eine Nitrogruppe ist in der organischen Chemie die funktionelle Gruppe –NO2. Der Bindungspartner kann Stickstoff oder Sauerstoff sein. Ist der Bindungspartner Stickstoff, zählt die Verbindung zu den Nitro-Verbindungen. Ist der Bindungspartner Sauerstoff (R–O–N=O), zählt die Verbindung zu den Salpetrigsäureestern.
In der mesomeriestabilisierten –NO2-Gruppe liegt ein negatives Sauerstoffatom und ein positives Stickstoffatom vor. Zwei Doppelbindungen am Stickstoff sind ungünstig, so dass man von einem neutralen und einem geladenen Sauerstoffatom ausgeht. Die –NO2-Gruppe hat bei aromatischen Verbindungen einen −M-Effekt und desaktiviert daher einen Benzolring bei der elektrophilen Substitution am Aromaten.
Eigenschaften
Nitrogruppen haben durch den 3-wertigen Stickstoff eine oxidierende Wirkung. Dies kommt zum Beispiel bei vielen Sprengstoffverbindungen zum Tragen. TNT (Trinitrotoluol) ist deshalb so brisant, weil es auf sieben Kohlenstoffatome drei Nitrogruppen hat. Das Molekül ist in sich selbst ein Oxidations- (Nitrogruppen) und ein Reduktionsmittel (Kohlenstoffatome). Auf dem –M-Effekt der Nitrogruppe beruht die antiauxochrome Wirkung in farbigen Verbindungen, z.B. bei der Pikrinsäure. Die bei der Behandlung von Proteinen mit konzentrierter Salpetersäure auftretende Gelbfärbung (Xanthoproteinreaktion) kommt durch die Nitrierung der aromatischen Aminosäuren zustande, deren Absorption dabei in den sichtbaren Bereich des Lichts verschoben wird.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 24.04. 2019