
Pikrinsäure
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | Schweiz: 0,1 mg/m3 (gemessen als einatembarer Staub) | |||||||
Pikrinsäure (gr. πικρος, pikros = bitter) ist der Trivialname für 2,4,6-Trinitrophenol (TNP). Die Säure besteht aus einem Benzolring, an den eine Hydroxygruppe(–OH) und drei Nitrogruppen (–NO2) als Substituenten gebunden sind. Sie gehört damit zur Stoffgruppe der Trinitrophenole. Ihre Salze heißen Pikrate.
Geschichte

Durch Behandlung von Indigo mit Salpetersäure konnte Peter Woulfe als erster 1771 Pikrinsäure darstellen. Neben der Gelbfärbung von Seide hatte sie jedoch zunächst noch keine größere Bedeutung.
Die Substanz war das erste detonierende, brisante Geschoss-Füllmittel und wurde als Lyddit, Ekrasit, Schimose oder Melinit ab 1886 so verwendet, nachdem der Franzose Eugène Turpin die Sprengstoffeigenschaften der lange zuvor bekannten Säure entdeckt hatte.
1864 verfasste der deutsche Arzt Wilhelm Erb eine Arbeit über Physiologische und therapeutische Wirkungen der Pikrin-Säure. 1865 habilitierte er sich auch mit einer Arbeit zu dieser Thematik.
Für die katastrophale Halifax-Explosion im Jahr 1917 waren 2.300 Tonnen Pikrinsäure verantwortlich.
Die Verwendung von Pikrinsäure zur Anfärbung von Backwaren im ausgehenden 19. Jahrhundert war weit verbreitet und war als Weltersches Bitter bekannt, was nach einer Häufung von Vergiftungsfällen jedoch unterbunden wurde.
| Strukturformel | ||
|---|---|---|
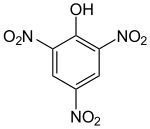 | ||
| Allgemeines | ||
| Name | Pikrinsäure | |
| Andere Namen |
| |
| Summenformel | C6H3N3O7 | |
| CAS-Nummer | ||
| EG-Nummer | 201-865-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Kurzbeschreibung | farblose bis leicht gelbe blatt- oder prismaförmige Kristalle, die extrem bitter schmecken und beim Erhitzen verpuffen | |
| Eigenschaften | ||
| Molare Masse | 229,11 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,76 g/cm3 | |
| Schmelzpunkt |
| |
| pKs-Wert | 0,29 | |
| Löslichkeit |
löslich in Ethanol (80 g/l bei 20 °C),
Benzol, wenig in Wasser (14 g/l bei 20 °C, 60 g/l bei 100 °C) | |
Darstellung und Gewinnung
Die Pikrinsäure wird über die Sulfonierung von Phenol und nachfolgende Behandlung mit Salpetersäure hergestellt. Alternativ bietet sich die Darstellung aus Chlorbenzol über 2,4-Dinitrochlorbenzol, 2,4-Dinitrophenol und dessen erneute Nitrierung an. Eine direkte Herstellung der Substanz gelingt durch die Oxynitrierung von Benzol durch konzentrierte Salpetersäure in Gegenwart von Quecksilber(II)-nitrat. Früher wurde Pikrinsäure auch aus Akaroidharz hergestellt.
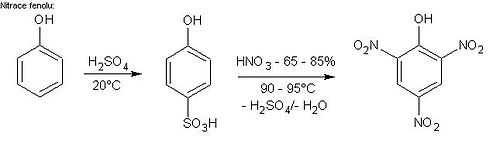
Eigenschaften
Pikrinsäure bildet farblose bis leicht gelbe, stark bitter schmeckende Kristalle. Sie ist nur schwer in kaltem Wasser löslich, besser löslich in siedendem Wasser und leicht löslich in Ethanolund Benzol. Bedingt durch die Häufung elektronenziehender Nitrogruppen (–NO2) reagiert die phenolische Hydroxygruppe der Pikrinsäure stark sauer (pKs = 0,29).
An der Luft verbrennt Pikrinsäure mit starker Rauchentwicklung; bei sehr raschem Erhitzen oder Initialzündung erfolgt Detonation. Pikrinsäure ist empfindlich gegen thermische (Hitze, Feuer) und mechanische (Schlag, Reibung) Belastung und gilt im Sinne des Sprengstoffgesetzes als explosionsgefährlicher Stoff. Für den Versand zur Verwendung als Laborchemikalie (siehe unten) wird die kristallisierte Säure durch Zugabe von etwas Wasser stabilisiert („phlegmatisiert“).
-
Tabelle mit wichtigen explosionsrelevanten Eigenschaften: Bildungsenergie −865,9 kJ/kg Bildungsenthalpie −936,2 kJ/kg Sauerstoffbilanz −45,4 % Stickstoffgehalt 18,34 % Normalgasvolumen 881 l/kg Explosionswärme 3546 kJ/kg (H2O (l))
3465 kJ/kg (H2O (g))Spezifische Energie 1033 kJ/kg (105,3 mt/kg) Bleiblockausbauchung 31,5 cm3/g Detonationsgeschwindigkeit 7350 m/s Stahlhülsentest Grenzdurchmesser 4 mm Schlagempfindlichkeit 7,4 N m Reibempfindlichkeit bis 353 N keine Reaktion
Pikrinsäure bildet mit zahlreichen anorganischen und organischen Basen Salze, die als Pikrate bezeichnet werden. Als starke Säure greift sie in wässriger Lösung zudem unedle Metalle unter Pikratbildung an. Einige der Salze z.B. Bleipikrat sind extrem empfindlich gegenüber Schlag, Reibung und Funken. Sie verhalten sich somit wie Initialsprengstoffe. Ammoniumpikrat wurde als Sprengstoff verwendet.
Ebenfalls als Pikrate bezeichnet werden die Charge-Transfer-Komplexe, die Pikrinsäure mit Aromaten bildet. Diese Feststoffe sind oft schwerlöslich und farbig. Wegen der charakteristischen und scharfen Schmelzpunkte (z.B. Benzol-Pikrat 84 °C, Toluol-Pikrat 88 °C, Anthracen-Pikrat 138 °C) wurde Pikrinsäure vor allem früher als Nachweisreagenz zur Identifikation von Aromaten verwendet.
Pikrinsäure ist giftig. Auf der Haut kann sie starke allergische Reaktionen hervorrufen. Die Kontamination mit Stäuben und Dämpfen ist daher zu vermeiden.
Verwendung
Primär dient die Pikrinsäure der Farbstoffindustrie zur Herstellung von 2-Amino-4,6-dinitrophenol (Pikraminsäure). Sie wurde früher zusammen mit Gummi arabicum und destilliertem Wasser zur Herstellung gelber Tinte verwendet. Ein weiteres Einsatzgebiet ist die organische Analytik zum Nachweis von Aminen, Alkaloiden und Kreatinin. Diese basischen Stoffe bilden gelbe Salze, welche durch ihren Schmelzpunkt charakterisiert wurden (Derivat-Bildung).
In der Histologie wird Pikrinsäure in dem Fixiergemisch nach Bouin (Bouinsche Lösung) verwendet.
Die Verwendung von Pikrinsäure als Füllmaterial für Granaten (wie im Ersten Weltkrieg) wurde wegen der unkontrollierten Bildung von sehr stoßempfindlichen Schwermetallpikraten eingestellt. Die Pikrinsäure wurde hier durch TNT ersetzt. In der Mikroskopie verwendet man Pikrinsäure als Bestandteil von Fixierflüssigkeiten (zur Konservierung zellulärer Strukturen) und zum Anfärben von Präparaten. Ein weiteres Einsatzgebiet von Pikrinsäure ist die Metallografie. Hier wird die Substanz zum Ätzen metallischer Oberflächen verwendet, z.B. bei der Präparation von Magnesiumlegierungen oder bei Seigerungsuntersuchungen an Stählen. Die Ätzung der Stähle wird mit Igeweskys-Reagenz, einer 5-%igen Lösung von Pikrinsäure in wasserfreiem Alkohol, durchgeführt. Pikrinsäure dient auch der Kreatinin-Konzentrationsmessung: Kreatinin bildet in alkalischer Lösung mit Pikrinsäure einen Meisenheimer-Komplex (Jaffé-Reaktion), dessen rote Farbe photometrisch gemessen wird.
Rechtliches
Pikrinsäure ist im Sinne des Sprengstoffgesetzes als explosionsgefährlicher Stoff der Stoffgruppe A (trocken) bzw. C (mit 25 % Wasser angefeuchtet) gemäß § 1 Abs. 3 Sprengstoffgesetz eingestuft. Für Privatpersonen ist trockene Pikrinsäure somit nach § 27 SprengG erlaubnispflichtig. Trocken ist Pikrinsäure in Lagergruppe 1.1 oder I bzw. als Gefahrgut in Klasse 1.1 (Stoffe, die massenexplosionsfähig sind) eingestuft, angefeuchtet mit 30 % Wasser in Lagergruppe 1.4.
Als handelsübliches Produkt ist Pikrinsäure mit > 30 % Wasser angefeuchtet und damit phlegmatisiert. Angefeuchtet (> 30 % Wasser) verhält sich Pikrinsäure wie ein entzündlicher Feststoff und wird zum Transport als Entzündbarer fester Stoff der Gefahrgutklasse 4.1 nach dem Europäisches Übereinkommen über die internationale Beförderung gefährlicher Güter auf der Straße (ADR) gekennzeichnet.

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 09.11. 2024

