Benzol
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK |
| ||||||||
| Toxikologische Daten | 930 mg/kg (LD50, Ratte, oral) | ||||||||
Benzol (nach IUPAC Benzen) ist ein flüssiger organischer Kohlenwasserstoff mit der Summenformel C6H6. Es besitzt einen charakteristischen aromatischen Geruch, ist farblos, leicht entzündlich und brennt mit stark rußender Flamme. Es mischt sich mit fast allen organischen Lösungsmitteln, jedoch kaum mit Wasser. Benzol ist die Stammverbindung der aromatischen Kohlenwasserstoffe.
Ursprünglich wurde Benzol bei der Koksproduktion für die Stahlindustrie erhalten. Heutzutage wird es meist durch Raffinerie- und petrochemische Prozesse wie Steamcracken als Nebenprodukt bei der Benzin-, Ethylen- und p-Xylolherstellung gewonnen. Daneben gibt es gezielte industrielle Herstellungswege für Benzol wie die Dealkylierung von Toluol.
Benzol ist ein wichtiger Baustein für die petrochemische Industrie, der globale Bedarf lag 2013 bei über 40 Millionen Tonnen pro Jahr. Durch Additions-, Substitutions- und Oxidationsreaktionen wird es in zahlreiche Folgeprodukte umgesetzt. Seine Derivate und Folgeprodukte wie Ethylbenzol, Cumol, Cyclohexan, Alkylbenzole, Chlorbenzole, Nitrobenzol und Maleinsäureanhydrid werden zu vielfältigen Produkten wie Farben, Arzneimitteln, Insektiziden und Kunststoffen für verschiedene Industrien weiterverarbeitet. Weiterhin ist es in Motorenbenzin enthalten, wobei in den meisten Ländern der Gehalt begrenzt ist. Benzol ist krebserregend und giftig.
| Strukturformel | ||
|---|---|---|
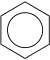 | ||
| Allgemeines | ||
| Name | Benzol | |
| Andere Namen | Benzen (systematischer Name) | |
| Summenformel | C6H6 | |
| Kurzbeschreibung | farblose Flüssigkeit mit charakteristischem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 200-753-7 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 78,11 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 0,88 g/cm3 | |
| Schmelzpunkt | 6 °C | |
| Siedepunkt | 80 °C | |
| Dampfdruck |
| |
| Löslichkeit | schlecht in Wasser (1,77 g/l) | |
| Brechungsindex | 1,5011 | |
Nomenklatur
Der Name Benzol wurde im Jahr 1834 erstmals von Justus von Liebig verwendet. Liebig änderte Eilhard Mitscherlichs Namensgebung von 1833, der das Benzol als Benzin bezeichnet hatte. Im angelsächsischen und französischen Sprachbereich wurde die adaptierte Bezeichnung (franz.: benzène, engl.: benzene) von Mitscherlich jedoch weiterhin benutzt.
Da in der systematischen chemischen Nomenklatur die Endung -ol für Alkohole verwendet wird, ist die im Deutschen meist verwendete, historisch bedingte Bezeichnung Benzol irreführend; der Name Benzen wurde von der IUPAC als offizielle Nomenklatur für diesen Kohlenwasserstoff bestimmt.
Geschichte
In der zweiten Hälfte des 17. Jahrhunderts entdeckte Johann Rudolph Glauber, der auch das Glaubersalz (Natriumsulfat) entdeckte, das Benzol bei der Destillation von Steinkohlenteer. Die Zusammensetzung war für ihn jedoch unbekannt, er nannte es ein „subtiles und liebliches Oleum“. Im Jahre 1825 entdeckte der englische Physiker Michael Faraday das Benzol im Leuchtgas, als er es aus flüssigen Rückständen isolierte, die sich beim Verbrennen von Walölen in den Londoner Straßenlaternen aus der Gasphase abschieden. Er schlug deshalb den Namen „Pheno“ (gr. phainein = leuchten) vor. Dieser Name ist Bestandteil des Begriffs der Phenylgruppe, der in der organischen Chemie die Atomgruppe –C6H5 bezeichnet.
Ein Jahr später wurde dieses Öl als Kohlenwasserstoff identifiziert. Im Jahre 1834 erhielt der deutsche Chemiker Eilhard Mitscherlich Benzol aus Benzoesäure und Calciumoxid, außerdem setzte er Benzol zu Nitrobenzol, Azobenzol und Benzolsulfonsäure um. Er benannte den Stoff wegen seiner Verwandtschaft zu Benzoesäure als „Benzin“. Außerdem erstellte er die richtige Summenformel C6H6. Im selben Jahr wurde „Benzin“ von Justus von Liebig in Benzol umbenannt. 1845 isolierte der englische Chemiker Charles Mansfield während seiner Arbeit unter Leitung von August Wilhelm von Hofmann Benzol aus Steinkohlenteer.
Um die korrekte Strukturformel des Benzols schwelte ein langer Gelehrtenstreit. Erste Ideen wie die von Albert Ladenburg vorgeschlagene Prisman-Struktur, die des Benzvalens, des Dicyclopropenyls sowie das Dewar-Benzol von James Dewar stellten sich als falsch heraus. Erst im Jahre 1861 formulierte der österreichische Chemiker Johann Josef Loschmidt, damals noch Schullehrer, einige mögliche Strukturformeln des Benzols, die der deutsche Chemiker und Professor für Chemie August Kekulé 1865 – möglicherweise als Anregung für seine Kekulé-Strukturformel – übernahm. Einer Legende nach kam Kekulé dieser Einfall im Traum. Er träumte von einer Schlange, die sich selbst in den Schwanz biss. Kekulé beschreibt dies in seiner Rede zum 25-jährigen Jubiläum des Benzolrings 1890. Die sechs Affen, die sich abwechselnd entweder mit beiden oder mit einer Hand an den Füßen fassten und so die Ringstruktur bildeten, beruhen auf einem 1886 bei einem Bierabend der Deutschen Chemischen Gesellschaft gemachten Scherz.
Kekulés Struktur trug als erste dem experimentellen Befund Rechnung, dass im Benzol alle Kohlenstoffatome gleichwertig sind. Sie erklärte aber nicht alle Besonderheiten des Benzols, wie beispielsweise seine ungewöhnlich niedrige Reaktivität im Vergleich zu Olefinen. Das Ausbleiben einer Additionsreaktion mit Bromwasser, wie sie nach der Kekulé-Strukturformel zu erwarten wäre, blieb rätselhaft. Der Beweis der Gleichwertigkeit der Wasserstoffe im Benzolmolekül konnte zwischen 1869 und 1874 erbracht werden. Im Jahre 1872 formulierte Kekulé seine „Oszillationshypothese“ eines dauernden Platzwechsels von Einfach- und Doppelbindungen.
-
Vorgeschlagene Strukturformeln _V.1.svg.png)
_V.1.svg.png)

.png)

_V.1.svg.png)
Von Adolf Karl Ludwig Claus (1867) Von James Dewar (1867) Von Albert Ladenburg (1869) Von August Kekulé (1872) Von Henry Edward Armstrong (1887),
Adolf von Baeyer (1888)Von Friedrich Karl Johannes Thiele (1899)
Erst im 20. Jahrhundert konnte das Phänomen der delokalisierten Elektronenwolken, die dem Benzolmolekül eine besondere Stabilität verleihen, über Röntgenstrukturanalyse nachgewiesen werden. 1925 führten Armit und Robinson die vereinfachte Schreibweise mit dem konzentrischen Kreis in der Formel ein, welcher zum Ausdruck bringen soll, dass alle Bindungen absolut gleichwertig sind und keine lokalisierbaren Doppelbindungen existieren. Eine rein hypothetische Form mit drei fixierten Doppelbindungen und drei Einfachbindungen würde als „1,3,5-Cyclohexatrien“ bezeichnet.
Im Jahr 1849 begann die industrielle Herstellung des Benzols auf der Basis von Steinkohle. Es wurde sorglos damit umgegangen, bis Kampagnen schließlich über 100 Jahre später über die Gefahren des Benzols aufklärten, als die Giftigkeit des Benzols bekannt wurde.
Vorkommen
Beim Rauchen von Zigaretten werden kleine Mengen Benzoldampf (10–100 µg pro Zigarette) freigesetzt, auch bei Vulkanausbrüchen und Waldbränden sowie bei unvollständiger Verbrennung von organischem Material, wie gehemmten Schwelbränden in der Natur sowie beim willentlich unvollständigen Schwelabbrand von Räucherstäbchen und Räucherwerk entstehen Spuren von Benzol. In der Atmosphäre wird nach zwei bis fünf Tagen die Hälfte des vorhandenen Benzols abgebaut, da dieses mit Hydroxyl-Radikalen reagiert.
Kleinere Mengen an Benzol kommen im Erdgas, Erdöl und Steinkohlenteer vor. Benzol löst sich zwar nur schlecht in Wasser, auf Grund des großen Wasserüberschusses bei einer lokalen Freisetzung von Erdöl löst es sich jedoch nahezu vollständig. Kommt es bei der Förderung oder dem Transport von Erdöl zu einer Freisetzung in mariner Umgebung, kann in Wasser gelöstes Benzol schon in Konzentrationen von wenigen parts per billion einen toxischen Effekt auf Fischlarven und andere marine Organismen haben. In höheren Konzentrationen von über einem part per million wirkt Benzol tödlich auf viele Wasserorganismen. Die Benzolexposition nach einer Freisetzung oder im Umgang mit Rohöl stellt auch ein gesundheitliches Risiko für die beteiligten Mitarbeiter dar. Die Analyse von gelöstem Benzol in Wasserproben von Explorationsbohrungen gilt als zuverlässige Methode zur Vorhersage von Erdölvorkommen. Geringe Mengen Benzol können auch in Erfrischungsgetränken vorkommen, so fand die Stiftung Warentest 2013 kleine Mengen Benzol in Kirschsaft. Das Vorkommen konnte dadurch erklärt werden, dass bei Lichtexposition aus Benzaldehyd Benzol entsteht, dies gilt für alle benzaldehydhaltigen Aromen.
Benzolemissionen
Hauptsächlich wird Benzol durch Abgase von Benzinmotoren freigesetzt. 75 Prozent der Emissionen gehen auf Kraftfahrzeuge zurück. Der Benzolanteil des Motorenbenzins ist ab dem Jahr 2000 europaweit nach DIN EN 228 auf maximal ein Volumenprozent begrenzt worden; der Durchschnitt im Jahre 2003 betrug ≈ 0,7 Volumenprozent. Der aktuelle Grenzwert lag 2010 in den USA bei fünf Volumenprozent. Ab 2013 sollte der US-Durchschnitt des Benzolanteils im Benzin zwar auf 0,62 Prozent reduziert werden, eine Begrenzung des Maximalanteils unter fünf Prozent war aber immer noch nicht vorgesehen.
Die durchschnittliche Belastung der Bevölkerung beträgt im Mittel circa 2 µg/m3 Luft, dieser Wert kann je nach Umgebung jedoch wesentlich höher sein (zum Beispiel an Tankstellen, in schlecht belüfteten Garagen etc.). Um 1980 gab es einen starken Rückgang der Benzolemissionen, der sich in den 1990er Jahren fortsetzte. So reduzierte sich die Benzolbelastung zwischen 1997 und 2005 sowohl an den städtischen, verkehrsnahen Messstationen als auch an den städtischen Hintergrundstationen so erheblich, dass schon im Jahr 2005 die erst seit dem Jahr 2010 geltenden Grenzwerte von 5 µg/m3 weitgehend unterschritten wurden.
Herstellung
Die in den 1950er Jahren gestiegene Nachfrage nach Benzol, vor allem durch die wachsende Polymerindustrie, erforderte die Herstellung von Benzol aus Erdöl. 2002 wurden global rund 94 Prozent des Benzols aus Erdöl gewonnen, davon 40 Prozent aus Pyrolysebenzin, 54 Prozent aus Reformatbenzin inklusive De- und Transalkylierung und fünf Prozent aus Kohle und Kohlenteer und etwa ein Prozent auf Basis von C3/C4-Schnitten. Jährlich werden weltweit etwa 40 Millionen Tonnen Benzol hergestellt.
Kohleverkokung
Für den kommerziellen Einsatz bis zum Zweiten Weltkrieg wurde das meiste Benzol als Nebenprodukt bei der Produktion von Koks für die Stahlindustrie erhalten, meist aus der Destillation von bei der Herstellung von aus Koks erzeugten leichten Ölen. Für die Suche nach Verwertungsmöglichkeiten wurde schon 1918 der Benzol-Verband gegründet. Es erwies sich als geeigneter Benzinzusatz, um dessen Klopffestigkeit zu erhöhen; so entstand das „Super“-Benzin aus aromatischen und aliphatischen Bestandteilen und führte zum Unternehmensnamen B. V. Aral. Diese traditionelle Methode zur Herstellung von Benzol wurde durch eine Reihe von neueren Prozessen ergänzt.
Steamcracken
Benzol wird in Europa vorwiegend aus dem Pyrolysebenzin des Steamcrackens gewonnen, eines Verfahrens zur Herstellung von Ethylen und anderen Olefinen aus aliphatischen Kohlenwasserstoffen. Abhängig von dem Ausgangsmaterial, das zur Herstellung der Olefine verwendet wird, wird ein benzolreiches flüssiges Nebenprodukt, das Pyrolysebenzin genannt wird, erhalten. Beim Einsatz schwererer Rohstoffe erhöht sich die Menge der erzeugten Aromaten. Pyrolysebenzin kann mit anderen Kohlenwasserstoffen als Benzinzusatz gemischt, durch ein Extraktionsverfahren oder durch Reaktivdestillation zur Gewinnung von Benzol und anderen Aromaten verwendet werden.
Katalytisches Reforming
Benzol wird durch katalytisches Reforming von Naphtha gewonnen. Dabei wird n-Hexan zu Cyclohexan cyclisiert und dann zu Benzol dehydriert. Beim katalytischen Reforming wird eine Mischung aus Kohlenwasserstoffen mit Siedepunkten zwischen 60 und 200 °C in Gegenwart von Wasserstoff über einen bifunktionellen Platin/Rhenium- oder Platin/Zinnchloridkatalysator bei 500–525 °C und Drücken im Bereich von 8–50 bar geleitet. Zur Optimierung der Aromatenausbeute wird ein C6/C8-Schnitt als Rohstoff eingesetzt. Die aromatischen Produkte der Reaktion können durch Extraktion mit einer Anzahl von Lösungsmitteln aus dem Reaktionsgemisch, auch Reformat genannt, abgetrennt werden. Benzol wird destillativ von den anderen Aromaten getrennt. In den Vereinigten Staaten ist die katalytische Reformierung eine Hauptquelle für Benzol.
Transalkylierung
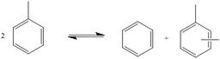
Bei der Transalkylierung werden zwei Toluolmoleküle zu einem Benzol- und einem Xylolmolekül transalkyliert. Als Katalysator dienen oft modifizierte Zeolithe. Da die Nachfrage nach p-Xylol die Nachfrage nach anderen Xylol-Isomeren übersteigt, kann eine Variante des Toluene Disproportionation Process [TDP-Prozesses und Selective TDP (STDP)] verwendet werden. Bei diesem Verfahren beträgt der aus der TDP-Einheit austretende Xylolstrom etwa 90 % p-Xylol.
Thermische Dealkylierung
Ein weiteres Verfahren zur Benzolherstellung ist die thermische Entalkylierung von Toluol. Hierbei wird bei 780 °C und einem Druck von 40 bar die Methylgruppe des eingesetzten Toluols abgespalten. Trägergas im Reaktor ist hierbei 90-prozentiger Wasserstoff. Nach Abkühlung und der Gas-Flüssigkeits-Trennung sowie Reinigung wird so Reinstbenzol gewonnen.
Herstellung aus nachwachsenden Rohstoffen
Benzol kann gemeinsam mit anderen Aromaten auch aus nachwachsenden Rohstoffen und Reststoffen hergestellt werden. Dafür sind verschiedene Pyrolysereaktionen bekannt. Aktuell wird die industrielle Produktion von verschiedenen Firmen in Pilotprojekten getestet oder wurde schon erfolgreich getestet, allerdings gibt es noch keine Produktion im großen Maßstab. In diesen Projekten werden nur Biomasse, die nicht in Flächenkonkurrenz zur Nahrungsmittelerzeugung steht, und Plastikmüll als Rohstoffe genutzt. Durch diese Produktionsweise kann die CO2-Bilanz im vergleich zur petrochemischen Herstellung der Aromaten um 70–90 % reduziert werden.
Weitere Prozesse
Aus Ethinmolekülen lässt sich in Anwesenheit eines Katalysators Benzol herstellen, was nach dem deutschen Chemiker Walter Reppe als Reppe-Chemie bezeichnet wird.
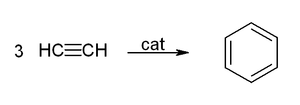
Diese Herstellmethode hat keine technische Relevanz.
Andere Prozesse zur Herstellung von Benzol beruhen auf Erdgas als Rohstoff über die Zwischenstufe Methanol, etwa Prozesse wie Methanol-to-Aromatics mit modifizierten Zeolithen des ZSM-5-Typs. Durch die Dehydrocyclodimerisierung von Erdgaskomponenten wie Propan und n-Butan lässt sich im Cyclar-Prozess ebenfalls Benzol gewinnen.
Eigenschaften
Physikalische Eigenschaften
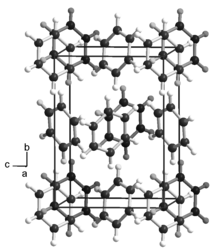
Benzol kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe Pbca (Raumgruppen-Nr. 61) und den Gitterparametern a = 746, b = 967 und c = 703 pm. Benzol ist eine farblose, klare, mit einem Brechungsindex von 1,5011 stark lichtbrechende, leicht flüchtige und leicht brennbare Flüssigkeit und brennt mit leuchtender, stark rußender Flamme. Der Brechungsindex von Benzol stimmt recht gut mit dem von Fensterglas überein. Ein Glasstab, der in Benzol eingetaucht ist, ist daher nahezu unsichtbar. Die Viskosität des Benzols ist geringer als die des Wassers, es ist dünnflüssiger. Es erstarrt bei 5,5 °C und siedet bei 80,1 °C. Bei Zimmertemperatur (20 °C) hat es eine Dichte von 0,88 Kilogramm pro Liter und einen Dampfdruck von 100 hPa.
Der thermische Ausdehnungskoeffizient
γ des flüssigen Benzols beträgt bei 25 °C;
0,00114 K−1, die relative Dielektrizitätskonstante
beträgt
2,28. Die spezifische Wärmekapazität
(flüssig) beträgt bei 20 °C; 1,738 kJ/kg·K, die Wärmeleitfähigkeit
bei 20 °C ist 0,144 W/(m·K), die dynamische Viskosität
bei 20 °C; 0,648 mPa·s,
dies ergibt die Prandtl-Zahl
bei 20 °C von 7,8. Die Verdampfungsenthalpie
beträgt am Verdampfungspunkt (80 °C); 30,75 kJ/mol, dies entspricht
einer Verdampfungsentropie
von 87 J/(K·mol).
Der Heizwert des Benzols beträgt
40.580 kJ/kg,
die Verbrennungsenthalpie
−3257,6 kJ/mol bei flüssigem Benzol und −3301 kJ/mol bei gasförmigem.
Molekulare Eigenschaften
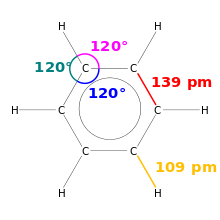
Eine Besonderheit ist, dass Benzol sechs gleich lange Bindungen von 139 pm besitzt. Dieser Wert liegt zwischen dem für eine Einfachbindung von etwa 147 pm und eine Doppelbindung von etwa 135 pm und ist ein Kennzeichen für den aromatischen Charakter von Benzol. Benzol ist der einfachste der benzoiden aromatischen Kohlenwasserstoffe, die auch Arene genannt werden. Die besonderen Bindungsverhältnisse dieser Stoffgruppe werden Aromatizität genannt. Die Länge aller Kohlenstoff-Wasserstoff-Bindungen beträgt 109 pm.
Jedes Kohlenstoffatom hat vier Valenzelektronen, von denen zwei das Atom mit den benachbarten C-Atomen verbinden. Ein Elektron bindet das zugehörige Wasserstoffatom. Die verbleibenden sechs π-Elektronen ergeben formal drei π-Bindungen, wie sie in der Strukturformel mit drei Doppelbindungen ausgedrückt wurden. In dem heute gültigen Orbitalmodell bilden die sechs π-Elektronen eine delokalisierte Ladungswolke (delokalisiertes 6-π-Elektronensystem) über und unter der Ebene des Kohlenstoffrings.
-

Molekülgeometrie und Aromatizität des Benzols
 |
| Mesomerie des Benzols. Die delokalisierten π-Elektronen sind energetisch günstiger als die Grenzstrukturen mit lokalisierten Doppelbindungen. Mesomerieenergie EM (Resonanzenergie) |
Kekulé drückte diesen Umstand der Mesomerie durch zwei Strukturformeln aus, die nur die beiden Extrempunkte der Ladungswolke symbolisieren. Aufgrund der Mesomerie ist der Kohlenstoffring stabiler als das hypothetische Cyclohexa-1,3,5-trien mit lokalisierten Doppelbindungen an festgelegten Positionen. In der vereinfachten Schreibweise wird der Kohlenstoffring heute als Sechseck und die Elektronenwolke als einbeschriebener Kreis dargestellt. Den Effekt der Mesomerie oder der Resonanz im Benzolmolekül erkannte aber erst Linus Pauling in den 1930er Jahren.
Benzol ist ein planares Molekül, bei dem die Kohlenstoffatome alle sp2-hybridisiert sind. Dies wurde von der britischen Kristallographin Kathleen Lonsdale durch Röntgenbeugung im Jahr 1929 bewiesen. Die Delokalisierung der Elektronen begründet die Äquivalenz aller CH-Gruppierungen im Molekül und damit die hohe Symmetrie, weswegen Benzol der Punktgruppe D6h angehört, also mit einer sechszähligen Achse versehen ist. Der Einfluss des π-Elektronensystems auf die Struktur ist jedoch nicht unumstritten. Im Sommer 2013 gelang es Forschern des Lawrence Berkeley National Laboratory, mit einem Rasterkraftmikroskop die hexagone Molekülgeometrie des Benzols nachzuweisen und fotografisch darzustellen.
Spektroskopische Eigenschaften
Im 1H-NMR-Spektrum zeigen die Wasserstoffatome eine ungewöhnlich schwache Abschirmung (Singulett bei 7,28 ppm in CDCl3 für alle sechs Wasserstoffatome), die durch den vom Magnetfeld des Spektrometers induzierten Ringstrom verursacht wird.
Im 13C-NMR-Spektrum zeigt Benzol in CDCl3 ein Signal bei 128,5 ppm für alle sechs Kohlenstoffatome.
Im IR-Spektrum erscheint die Phenyl-Wasserstoffschwingung bei etwa 3.035 cm−1. Die C–C-Valenzschwingung erscheint bei 1.500 bis 2.000 cm−1. Bei 650 bis 1.000 cm−1 befinden sich die C–H-Deformationsschwingungen.
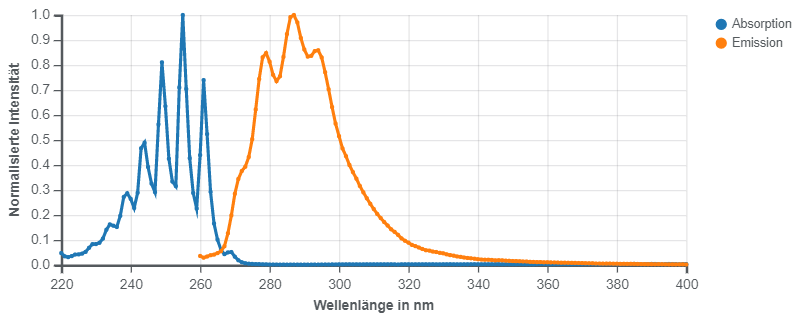
UV-spektroskopisch lässt sich Benzol noch in hoher Verdünnung an zwei typischen Absorptionen (π-π* Übergänge) im Bereich von 200 bis etwa 250 nm nachweisen.
Chemische Eigenschaften
Mit unpolaren, organischen Lösungsmitteln wie Ether, sowie mit Methanol, Ethanol, Essigsäureethylester, Aceton ist Benzol in jedem Verhältnis unbegrenzt mischbar, mit Wasser jedoch nur schlecht (maximal 1,8 Gramm Benzol pro Liter). Benzol bildet mit 8,83 % Wasser ein Azeotrop, das bei 69,25 °C siedet.
Oxidation
Benzol verbrennt mit gelber Flamme zu Wasser und Kohlenstoffdioxid, wobei die starke Rußentwicklung auf den hohen Kohlenstoffanteil der Verbindung hinweist. Benzol hat einen charakteristischen Geruch. Die Geruchsschwelle ist sehr niedrig und liegt bei 1,5 bis 900 Milligramm pro Kubikmeter Luft. Die Verbrennung im Motor als Ottokraftstoff ist eine der mengenmäßig größten Reaktionen von Benzol.
Vollständige Oxidation (Verbrennung) des Benzols:
- Mit Sauerstoff reagiert Benzol zu Kohlenstoffdioxid und Wasser.
Durch katalytische Oxidation von Benzol mit Luftsauerstoff mittels eines Vanadiumpentoxid-Katalysators bei etwa 450 °C entsteht Maleinsäureanhydrid. Aufgrund des Verlustes der geringen Atomökonomie werden jedoch Verfahren mit einem C4-Rohmaterial bevorzugt.
Radikalische Substitution
Radikalische Substitutionen am Benzol finden im Vergleich zu Alkenen aufgrund der Stabilisierung durch die Aromatizität nicht statt. Eine Ausnahme bildet hierbei die sogenannte Sandmeyer-Reaktion, bei der aus Diazoniumsalzen in einer durch Kupfer katalysierten homolytischen Abspaltung von molekularem Stickstoff ein Phenyl-Radikal entsteht. Dieses ist aber hochreaktiv und reagiert sofort weiter. Ein wichtiges Merkmal der Aromatizität von Benzol ist das Ausbleiben einer Additionsreaktion mit Bromwasserstoffsäure oder Bromwasser.
Radikalische Addition
Beispiel für eine radikalische Additionsreaktion (Chlorierung):
- Mit Chlor reagiert Benzol zu Lindan.
Die Addition von Chlor an Benzol verläuft als Radikalkettenreaktion:
- […]
Die Reaktion wird bei einer Temperatur von 15 bis 20 °C durchgeführt. Bei einem Umsatz von 12 bis 15 % wird die Reaktion abgebrochen und das Reaktionsgemisch aufgearbeitet.
Elektrophile aromatische Substitution
Ein Beispiel für eine elektrophile aromatische Substitution ist die Nitrierung von Benzol. Dabei bildet sich durch Protonierung von Salpetersäure mit konzentrierter Schwefelsäure ein reaktives Nitroniumion:
Dieses reagiert als Elektrophil mit dem Benzol:
- Mit Salpetersäure reagiert Benzol in Gegenwart von Schwefelsäure zu Wasser und Nitrobenzol.
Die Umsetzung von Benzol zu Nitrobenzol beschrieb Eilhard Mitscherlich im Jahr 1834, die industrielle Produktion von Nitrobenzol, einem wichtigen Grundstoff für die Farbenindustrie, wurde schon 1847 aufgenommen.
Auch bei der Friedel-Crafts-Alkylierung handelt es sich um eine elektrophile aromatische Substitution. Unter der katalytischen Wirkung einer Lewissäure wie Eisen(III)-chlorid (FeCl3) oder Aluminiumchlorid (AlCl3) oder einer starken Brønsted-Säure wie Schwefelsäure (H2SO4), Phosphorsäure (H3PO4) oder Fluorwasserstoff (HF) wird Benzol mit einem Alkylhalogenid, einem Alkohol, einem Alken oder einem Alkin zu einem Alkylaromaten umgesetzt.
Die entstehenden Alkylaromaten finden Verwendung als Rohstoffe für Waschmittel.
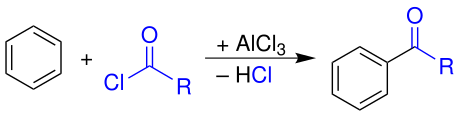
Durch eine Friedel-Crafts-Acylierung wird Benzol ebenfalls unter Lewissäure-Katalyse mit Carbonsäurehalogeniden umgesetzt. Dadurch wird eine Acylgruppe eingeführt.
Metallorganische Reaktionen
chromium-2D-skeletal.png)
Bis heute wurden in der metallorganischen Chemie viele Komplexe synthetisiert, die Benzol als Ligand enthalten. Eine bekannte Verbindung ist das erstmals 1955 von Ernst Otto Fischer und Walter Hafner dargestellte Bis(benzol)chrom, ein sogenannter Sandwichkomplex Für die Synthese und die Untersuchung der Chemie des Bis(benzol)chroms und der Chemie der metallorganischen Sandwich-Verbindungen erhielt Ernst Otto Fischer 1973 den Nobelpreis für Chemie.
Die Haptizität von Benzol als Ligand kann bei Redox-Reaktionen wechseln, etwa bei der Reduktion des Bis(benzol)ruthenium-Kations.
Benzolderivate und Substitutionsmuster
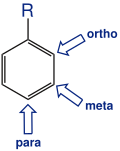
muster am Aromaten
Bei der Monoderivatisierung des Benzols, bei der ein Wasserstoffatom durch eine andere Gruppe ersetzt wurde, entsteht auf Grund der Äquivalenz aller Wasserstoffatome nur ein mögliches Derivat. Bei der Einführung von zwei gleichen Substituenten treten drei verschiedene Derivate auf . Die relative Stellung der Substituenten wird mit ortho-, meta- und para- gekennzeichnet. Bei der Einführung von drei gleichen Substituenten treten wiederum drei Isomere auf, die vicinal, symmetrisch und asymmetrisch genannt werden.
-
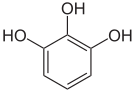
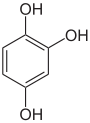
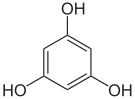
Pyrogallol,
1,2,3-Trihydroxybenzol,
vicinal-TrihydroxybenzolHydroxyhydrochinon,
1,2,4-Trihydroxybenzol,
asymmetrisch-TrihydroxybenzolPhloroglucin,
1,3,5-Trihydroxybenzol,
symmetrisch-Trihydroxybenzol
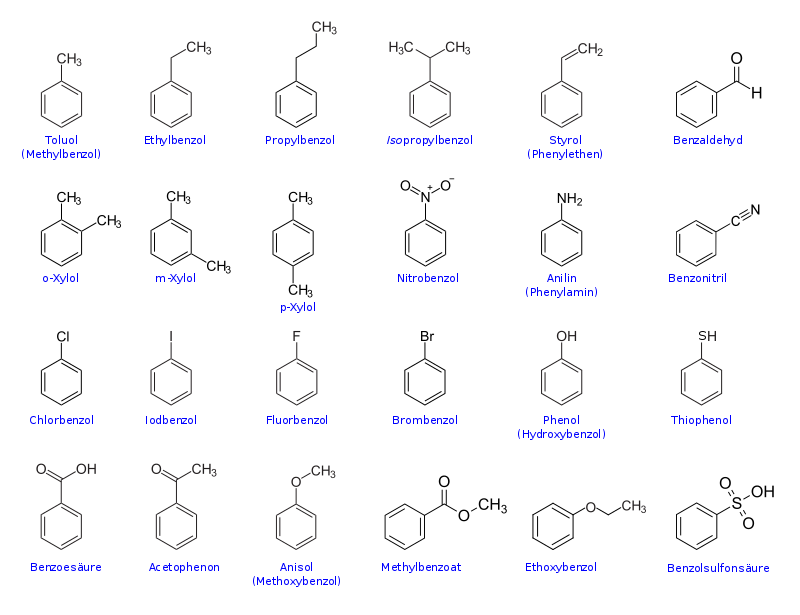
Viele wichtige Chemikalien sind Derivate des Benzols, haben also einen Benzolring als Grundgerüst. Es folgt eine Übersicht über die wichtigsten und einfachsten Derivate des Benzols, welche selbst Grundstoffe für weitere Chemikalien darstellen:
Verwendung
In der Vergangenheit fand Benzol als gutes Lösungs- und Reinigungsmittel in vielen Bereichen Verwendung. Als Lösungsmittel für Wachse, Harze und Öle wird Benzol zunehmend durch weniger giftige Stoffe verdrängt. Auch wurde es zur Entkoffeinierung von Kaffee im sogenannten Roselius-Prozess eingesetzt. Im 19. und frühen 20. Jahrhundert wurde Benzol wegen seines angenehmen Geruchs als ein After-Shave benutzt.
Wegen der damit verbundenen Gefahren dürfen in Deutschland Benzol und benzolhaltige Zubereitungen mit über 0,1 Prozent nicht in Verkehr gebracht werden. In größeren Mengen darf Benzol nur in geschlossenen Systemen und zu industriellen oder Forschungszwecken verwendet werden. Eine Ausnahme bilden hier Treibstoffe; Benzol erhöht die Klopffestigkeit von Benzin, weshalb es in der Entwicklung der Ottokraftstoffe eine wichtige Rolle einnahm. Einige frühere Lokomotiven mit Verbrennungsmotor benutzten einen Treibstoff, der hauptsächlich aus Benzol bestand. Heute ist es nur noch als Kraftstoffzusatz in einer Konzentration bis zu einem Prozent zulässig.
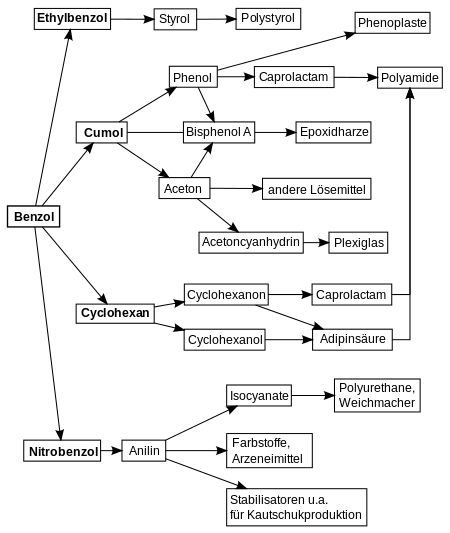
Benzol wird in der Petrochemie für die Synthese vieler Verbindungen gebraucht, vorwiegend Ethylbenzol (52 %), Cumol (20 %), Cyclohexan (13 %) und Nitrobenzol (9 %). Diese Verbindungen sind, wie die Abbildung rechts zeigt, wiederum Ausgangsstoffe zur Synthese von Verbindungen, wie Styrol, Phenol, Aceton, Cyclohexanol, Cyclohexanon und Anilin. Auf ihnen basieren Kunststoffe, wie Polystyrol, Styrol-Butadien-Kautschuk, Polyamide (Nylon) und Epoxidharze. Viele weitere Produkte, wie waschaktive Salze der Alkylbenzolsulfonsäuren, technische Lösemittel, bestimmte Pestizide wie Lindan und Farbstoffe basieren auf Benzol oder seinen Folgeprodukten.
Sicherheitstechnische Kenngrößen
Die Verbindung hat einen Flammpunkt bei −11 °C. Benzol bildet leicht entzündliche Dampf-Luft-Gemische. Der Explosionsbereich liegt zwischen 1,2 Volumenprozent (39 g/m3) als untere Explosionsgrenze (UEG) und 8,6 Volumenprozent (280 g/m3) als obere Explosionsgrenze (OEG). Die Grenzspaltweite wurde mit 0,99 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsklasse IIA. Die Mindestzündenergie liegt bei 0,2 mJ. Damit können energetisch schwächere Zündquellen wie Büschelentladungen und Schleif- beziehungsweise Schlagfunken eine Entzündung von Dampf-Luft-Gemischen innerhalb der Explosionsgrenzen bewirken. Die Zündtemperatur beträgt 555 °C. Der Stoff fällt somit in die Temperaturklasse T1.
Toxikologie

Benzoldämpfe sind (ebenso wie die seiner Derivate Xylol und Toluol) beim Einatmen giftig; die Symptome einer akuten Benzolvergiftung treten erst bei relativ hohen Konzentrationen ein. Leichte Vergiftungen äußern sich in Kopfschmerzen, Schwindelgefühl, Brechreiz, Benommenheit und Apathie. Bei einer schweren Vergiftung kommt es zu Fieber und Sehstörungen bis hin zu vorübergehender Erblindung und Bewusstlosigkeit. Bei der sogenannten Benzolsucht, die beim Einatmen von Benzol eintreten kann, kommt es zu Trunkenheits- und Euphoriegefühlen. Benzol kann bei längerer Einwirkung auf den Organismus zum Tod führen.
Die Giftwirkung ebenso wie die karzinogene Wirkung als Klastogen ist auf die Bildung eines karzinogenen Metaboliten zurückzuführen. Im Körper wird Benzol enzymatisch am Ring oxidiert. Das entstehende hochreaktive Epoxid (Arenoxid) reagiert mit zahlreichen biologischen Verbindungen und kann das Erbgut schädigen beziehungsweise Protein-Addukte bilden. Das Arenoxid wird weiter zu Phenol metabolisiert. Durch Hydrolasen kann das hochreaktive Arenoxid zum trans-1,2-Dihydrobenzol-1,2-diol weiter reagieren. Außerdem kann das Arenoxid reversibel zum Oxepin umlagern. Diese Weiterreaktionen verlaufen nicht-enzymatisch. Eine langzeitige Aufnahme kleinerer Benzolmengen führt vor allem zu Schädigungen der inneren Organe und des Knochenmarks. Letzteres resultiert in einer Abnahme der Zahl der roten Blutkörperchen (Anämie), was sich in Herzklopfen, Augenflimmern, Müdigkeit, Schwindel, Blässe und Kopfschmerzen äußert. Benzol wird im Gehirn, Knochenmark und Fettgewebe gespeichert. Es wird nur langsam über die Niere ausgeschieden. Der Abbau erfolgt über verschiedene Umbauprodukte wie das Brenzcatechin, Phenol, Hydrochinon und Benzochinon. Das Hauptausscheidungsprodukt ist schließlich die Phenylmercaptursäure (N-Acetyl-S-phenyl-cystein).
Bei zwei Prozent Luftvolumenanteil Benzol in der Atemluft kommt es nach fünf bis zehn Minuten zum Tod. Die akute letale Dosis (oral) beträgt beim Menschen 50 Milligramm pro Kilogramm Körpergewicht. Zwischen einem Luftvolumenanteil von 1,4 bis 8 Prozent bildet Benzol explosive Gemische.
Benzol ist wegen dieser Gefahren mit besonderer Vorsicht zu handhaben. Benzol muss bei 15 °C bis 25 °C gelagert werden. Der TRK-Wert lag bei 1 Milliliter pro Kubikmeter Luft (beziehungsweise 3,25 mg/m3 Luft). Jede Exposition gegenüber Benzol sollte möglichst vermieden oder verringert werden; vor dem Gebrauch von Benzol sind besondere Anweisungen einzuholen. Bei Unfall oder Unwohlsein sollte sofort ein Arzt hinzugezogen werden. Orte, an denen Benzol austritt oder austreten könnte, sollten sofort verlassen und nur in Vollschutzanzügen wieder betreten werden. Benzol ist stark wassergefährdend.
Hexadeuterobenzol
Deuteriertes Benzol (Summenformel: C6D6), auch Hexadeuterobenzol oder Benzol-d6 genannt, findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung.
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:
- Brechungsindex: 1,497 (20 °C)
- Schmelzpunkt: 6,8 °C
- Siedepunkt: 79,1 °C
- Dichte: 0,950 g/ml (25 °C)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.08. 2025



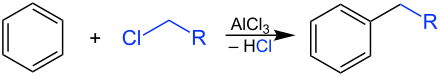
2.png)