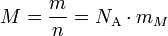SI Einheiten
Molare Masse
| Physikalische Größe | |||||||
|---|---|---|---|---|---|---|---|
| Name | Molare Masse | ||||||
| Formelzeichen der Größe | 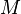 | ||||||
| |||||||
Die molare Masse M (auch Molmasse; unüblich stoffmengenbezogene Masse) ist der Quotient aus der Masse m und der Stoffmenge n eines Stoffes: M = m/n. SI-Einheit ist kg/mol; in der Chemie ist g/mol üblich.
Der Zahlenwert der molaren Masse einer chemischen Verbindung ergibt sich durch die Summe der mittleren Atommassen der an der Verbindung beteiligten chemischen Elemente von einem Mol (rd. 6·1023) Teilchen bzw. von einem Mol der Strukturelemente der Verbindung. Im Fall von molekularen Verbindungen wird die Summenformel des Moleküls und im Fall von nichtmolekularen Verbindungen (Metalle und Ionenverbindungen) die Verhältnisformel der Verbindung zur Berechnung der molaren Masse verwendet. Der Zahlenwert der molaren Masse in g/mol entspricht der relativen Molekülmasse.
Die molare Masse ist eine Stoffkonstante und damit eine intensive Größe im Gegensatz zu allen extensiven Größen.
Definition
Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- m Masse
- n Stoffmenge
- NA Avogadro-Konstante
- mM Teilchenmasse
Berechnung
Die molare Masse einer Verbindung kann berechnet werden, wenn man ihre Summenformel kennt: Zu jedem Element entnimmt man aus der Summenformel die Indexzahl sie steht in der Summenformel hinter dem Elementsymbol. Zu jedem Element muss man dann z.B. aus Tabellen die molare Masse entnehmen ihr Zahlenwert ist gleich der relativen Atommasse. Dann erhält man die molare Masse als Summe der molaren Massen der Elemente, die die Verbindung aufbauen:
Die molare Masse einer Verbindung ist gleich der Summe aus den molaren Massen der Elemente multipliziert mit ihren Indexzahlen.
Beispiel für Wasser (H2O):
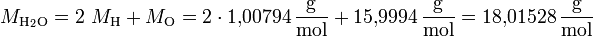
Aus den molaren Massen der chemischen Elementekann man die molaren Massen aller Verbindungen berechnen.
| Element | Elementsymbol | Ordnungszahl | Molare Masse |
|---|---|---|---|
| Wasserstoff | H | 1 | 1,00794 g/mol |
| Kohlenstoff | C | 6 | 12,0107 g/mol |
| Sauerstoff | O | 8 | 15,9994 g/mol |
| Verbindung | Summenformel | Zahl der Atome | Molare Masse |
| Wasserstoff | H2 | 2 | 2,01588 g/mol |
| Sauerstoff | O2 | 2 | 31,9988 g/mol |
| Wasser | H2O | 3 | 18,01528 g/mol |
| Methan | CH4 | 5 | 16,043 g/mol |
Bestimmung
Für die Bestimmung der Molmassen von Molekülen war das Avogadrosche Gesetz
bestimmend. Im Gaszustand nehmen bei gleicher Temperatur gleich viele Moleküle
einen nahezu identischen Rauminhalt ein.
Für einfache Moleküle wie Chlor, Wasserstoff, Chlorwasserstoff, Sauerstoff,
Wasserdampf konnten die Verhältnisse aus Wägungen der Gase nach einer
Elektrolyse ermittelt werden.
Mit dem Verfahren nach Bunsen> lassen sich molare Massen von Gasen über die Ausströmungszeiten ermitteln.
Für komplizierte organische Moleküle nutzte man zunächst ebenfalls das Avogadrosche Gesetz, indem man die reinen organischen Stoffe verdampfte und das verdrängte Wasservolumen bestimmte. Die Methode wurde erst von Joseph Louis Gay-Lussac angewendet, später von Victor Meyer verbessert. Ein etwas älteres Verfahren ist das nach Dumas, bei dem ebenfalls die Stoffe verdampft wurden.
Viele Methoden zur Bestimmung der Molmasse beruhen auf der Messung von Effekten, deren Größe nur abhängig von der Anzahl der verursachenden Teilchen, nicht aber von deren Masse ist (kolligative Effekte). Zu diesen Methoden zählt die Messung der Gefrierpunktserniedrigung (Kryoskopie), die Messung der Siedepunktserhöhung (Ebullioskopie) und Osmometrie.
Für nicht verdampfbare Moleküle nutzte man früher die Gefrierpunktserniedrigung oder den osmotischen Druck von Lösungen. Die letztere Methode entwickelte Jacobus Henricus van't Hoff.
Bei der Massenspektrometrie ergibt sich die relative Molmasse aus dem Molekülpeak. In der hochauflösenden Massenspektrometrie kann die Molmasse mit vier Nachkommastellen ermittelt werden, so dass auch die Summenformel bestimmt werden kann.

Datum der letzten Änderung: Jena, den: 30.05. 2021