Aromaten
| Wichtigster Aromat: Benzol |
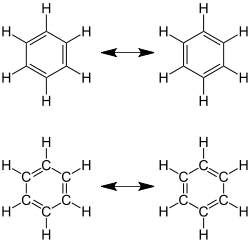 Mesomere Grenzstrukturen von Benzol mit sechs π-Elektronen in delokalisierten Doppelbindungen, einer der einfachsten aromatischen Verbindungen. (Hinweis: Die Präsentationen oben und unten sind gleichwertig.) |
 Die delokalisierten Elektronen und die Gleichheit der Bindungen des Benzolmoleküls wird durch einen Kreis symbolisiert. |
.png) Historische Kekulé-Benzol-Formel aus der Originalpublikation. |
Aromatische Verbindungen, kurz auch Aromaten, sind eine Stoffklasse in der organischen Chemie. Ihr Name stammt vom aromatischen Geruch der zuerst entdeckten Verbindungen dieser Stoffklasse.
Aromatische Moleküle besitzen mindestens ein Ringsystem, das nach der Hückel-Regel in konjugierten Doppelbindungen, freien Elektronenpaaren oder unbesetzten p-Orbitalen eine Anzahl von 4n+2 (n=0,1,2,…) delokalisierten Elektronen enthält. Diese Delokalisierung führt zu einem besonderen Bindungssystem, in dem im Ring nicht zwischen Einzel- und Doppelbindungen unterschieden werden kann. In einfachen, symmetrischen Ringsystemen wie beim Benzolsind damit alle Bindungen identisch. In Strukturformeln werden zur Verdeutlichung alle mesomeren Grenzstrukturen dargestellt oder die Einfachbindungen mit einem (manchmal gestrichelten) Ring versehen, der die delokalisierten Elektronen symbolisiert. Aromaten sind im Vergleich zu nichtaromatischen Doppelbindungssystemen energieärmer und deshalb weniger reaktiv. Insbesondere neigen sie nicht zu Additionsreaktionen.
Aromatizitätskriterien
Historische Definitionen
- Benzol ist die einfachste aromatische Verbindung, mit dem alle anderen Aromaten durch die Struktur verwandt sind. Sie besitzen oft einen angenehmen, aromatischen Geruch. Von diesem typischen Geruch leitet sich die Bezeichnung Aromat, aus gr. ‚aroma‘=‚Duft‘, ab.
Allerdings lassen sich die Aromaten nicht über den Geruch definieren, da bei hoher molarer Masse oder stark polaren Substituenten oft kein Geruch wahrnehmbar ist.
- Aromaten sind mehrfach ungesättigte Verbindungen, die gegenüber der Addition an der Doppelbindung relativ reaktionsträge sind und die stattdessen relativ leicht direkt an einer Doppelbindung eine Substitution eingehen.
Diese Namensbestimmung, die eine experimentelle Unterscheidung erlaubt, war beispielsweise im 20. Jahrhundert gültig, schon bevor die Struktur- und Bindungsverhältnisse geklärt waren. Heute wird in der Regel eine allgemeinere Definition über die elektronische Struktur bevorzugt. Die angegebenen Eigenschaften – kurz: Substitution statt Addition – sind natürlich dennoch charakteristische und sehr wichtige Merkmale.
- Das Bindungssystem der Aromaten zeigt eine besondere Stabilität, die zum Beispiel durch den Vergleich der Hydrierungsenthalpie des Aromaten mit einer entsprechenden nichtaromatischen und hypothetischen Bezugsverbindung (im Fall von Benzol Cyclohexatrien) als Resonanzenergie bestimmt werden kann.
- Die Resonanzfrequenz der Wasserstoffatome im Kernresonanzexperiment ist charakteristisch. Diese äußert sich in einer starken Tieffeldverschiebung für Protonen außerhalb des aromatischen Systems und einer Hochfeldverschiebung für Protonen innerhalb des aromatischen Systems.
Definition der Aromaten
Notwendige, aber nicht hinreichende Voraussetzungen für einen Aromaten:
- Ein cyclisches Molekül, das heißt, es hat mindestens einen Ring, der in vielen Fällen ein Benzolring ist.
- Ein vollständig über den Ring konjugiertes Doppelbindungs-System.
Das sind entweder- mehrere Doppelbindungen, die bei Kohlenwasserstoffen jeweils durch genau eine Einfachbindung getrennt sind (Im Sonderfall der Arine kann auch eine Dreifachbindung auftreten.) oder
- eine oder mehrere Doppelbindungen, die durch positiv oder negativ geladene Kohlenstoffatome oder durch Heteroatome getrennt sind.
Gleichbedeutend und kürzer lautet diese Bedingung:
- alle Atome des Rings sind sp2-hybridisiert.
Ein Aromat liegt dann vor, wenn auch die folgenden Bedingungen erfüllt sind:
- Das Doppelbindungssystem ist planar; in Ausnahmefällen sind leichte Abweichungen von der Ebene gestattet. Zum Beispiel ist in einigen Cyclophanen die Benzoleinheit in einem Winkel von bis zu 30° bootförmig deformiert.
- Die Zahl der delokalisierten Elektronen muss der Hückel-Regel genügen, das heißt im konjugierten Elektronensystem müssen 2 oder 6 oder 10 oder 14… Elektronen vorliegen:
Die von Erich Hückel aufgestellte Hückel-Regel wird meist durch die Formel (4n + 2) π-Elektronen (n = 0,1,2,3…), delokalisiert über alle Ringatome des Systems, wiedergegeben. Cyclisch konjugierte π-Systeme mit 4n π-Elektronen (n = 1,2,3…) heißen Antiaromaten.
Die Grundstruktur vieler aromatischer Verbindungen ist das Benzol C6H6. (Die Hückel-Regel ist hier mit n=1 erfüllt: Benzol besitzt 6 π-Elektronen.) Das Benzol wird daher als einer der einfachsten aromatischen Kohlenwasserstoffe angesehen – insbesondere da die besonderen Eigenschaften aromatischer Verbindungen am Benzol und dessen Derivaten entdeckt wurden. Benzol ist gegenüber einem hypothetischen (das heißt nicht herstellbaren) Cyclohexatrien mit lokalisierten Doppelbindungen stabiler und damit weniger reaktiv.
Aromatische Ionen
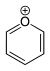
Da laut Hückel-Regel
auch ein planares, cyclisch konjugiertes System mit 2 π-Elektronen als Aromat
gilt, enthalten auch Cyclopropenium-Salze aromatische Kationen:
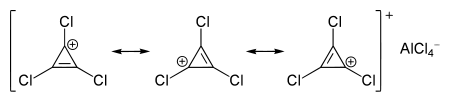
Der Cyclopropenylring ist deutlich kleiner als der Benzolring, da hier n = 0 ist, während beim Benzol n = 1 ist.
Ebenfalls aromatisch ist das negativ geladene Cyclopentadienyl-Anion, das in Metallocenen wie Ferrocen vorkommt:
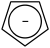
Wie beim Benzol ist hier n = 1.
Reaktionen von Aromaten
Am wichtigsten sind Substitutionsreaktionen, beispielsweise
- Elektrophile aromatische Substitution, wie die Sulfonierung, Nitrierung, Friedel-Crafts-Acylierung, Azokupplung, Chlorierung, Bromierung. Für die elektrophile Zweitsubstitution am Aromaten gelten spezielle Regeln. Bereits am Aromaten vorhandene Substituenten „dirigieren“ die weiteren Substitution in bestimmte Positionen.
- Nukleophile aromatische Substitution
- Dearomatisierung: Verlust des aromatischen Systems durch entsprechende Reduktion.
Einteilung der Aromaten
Kriterien
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Es gibt eine gewaltige Zahl (mehrere Millionen sind bekannt) verschiedenster aromatischer Verbindungen. Sie können nach verschiedenen Kriterien in Gruppen eingeteilt werden:
- Wie alle chemischen Verbindungen, bei denen zwischen organisch (enthält Kohlenstoffatome) und anorganisch unterschieden wird, können auch die Aromaten entsprechend in organisch und anorganisch unterteilt werden. Ein anorganischer Aromat ist beispielsweise das Borazol B3N3H6, das sich formal vom Benzol C6H6 ableiten lässt, indem man die Kohlenstoffatome abwechselnd durch Stickstoffatome oder Boratome ersetzt. Allerdings ist Borazol eher auf dem Papier aromatisch denn in der Praxis: Die Elektronendichten sind stark an den Stickstoffatomen lokalisiert (anstatt über den Ring gleichmäßig verteilt) und der Ring ist stark gewellt. Auch die Reaktivität bei Angriff des Rings durch Nukleophile oder Elektrophile (im Gegensatz zum trägen Benzol) zeigt eine deutliche Bindungspolarisierung.
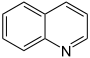
- Ringsysteme, die nur aus Kohlenstoffatomen bestehen, nennt man Carbocyclen. Benzol C6H6 und Naphthalin C10H8 gehören demnach zu den Carbocyclen. Heteroaromaten enthalten dagegen wie alle Heterocyclen im Ringsystem selbst andere Atome wie etwa Stickstoff, zum Beispiel im Aromaten Pyridin C5H5N. (Pyridin leitet sich formal vom Benzol ab, indem eine C–H-Atomgruppe durch N ersetzt wird.)
- Carbocyclische Aromaten (= mit Kohlenstoffatom-Aromatengerüst) können in (aromatische) Kohlenwasserstoffe und substituierte Aromaten unterteilt werden (entsprechend der Einteilung der organischen Verbindungen). Benzol C6H6 und Toluol C6H5-CH3 sind Kohlenwasserstoffe, Phenol C6H5-OH und Trinitrotoluol TNT C6H2(NO2)3(CH3) sind daraus durch Substitution abgeleitete Verbindungen.
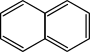
- Eine weitere Einteilung erfolgt nach der Zahl der aromatischen Cyclen: Eine der einfachsten aromatischen Verbindungen, das Benzol, besteht aus genau einem Ring. Naphthalin C10H8 ist ein Bicyclus, es besitzt ein aromatisches π-System mit 10 π-Elektronen, welches über die beiden Ringe verteilt ist.
- Aromaten mit mehreren Ringen können eingeteilt werden in solche, bei denen die Ringe gemeinsame Atome haben (kondensierte oder anellierte Ringe), wie im Naphthalin C10H8, oder solche, mit separaten (isolierten) Ringen, beispielsweise Biphenyl C6H5-C6H5.
- Eine weitere Einteilung kann nach der Zahl der Ringatome des aromatischen Systems erfolgen. Typisch sind sechs Ringatome, etwa beim Benzol C6H6. Um einen geschlossenen Ring zu bilden, sind mindestens drei Atome nötig, und dementsprechend existieren Aromaten mit drei, vier, fünf – etwa beim C5H5− Cyclopentadien-Anion, sieben oder mehr Atomen.
- Nach der Ladung des aromatischen Systems, zum Beispiel ist das Cyclopentadien-Anion einfach negativ geladen.
Beispiele aromatischer Verbindungen
Kohlenwasserstoffe
Aromatische Kohlenwasserstoffe werden auch Arene genannt. Beispiele dafür sind:
- Benzol C6H6
- Toluol (Methylbenzol) C6H5–CH3
- Xylol (Dimethylbenzol) H3C–C6H4–CH3
- Mesitylen (Trimethylbenzol) C6H3(CH3)3
Kohlenwasserstoffe mit mehreren Ringen werden polyzyklische aromatische Kohlenwasserstoffe (PAK) genannt, das sind zum Beispiel:
- Naphthalin C10H8 (2 Ringe; zwei mal Sechsring)
- Azulen C10H8 (2 Ringe; Fünf-/Siebenring )
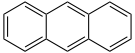
- Anthracen C14H10 (3 Ringe)
Annulene, also cyclische Kohlenwasserstoffe mit konjugierten Doppelbindungen, können Aromatizität aufweisen. Nach Benzol ist [14]-Annulen das kleinste aromatische Annulen, ebenfalls aromatisch sind Annulene mit 18 und 22 Kohlenstoffatomen.
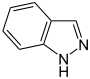
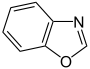
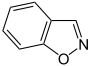
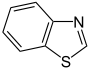
Aromatische Ionen
| ||||||||
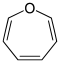
Das freie Elektronenpaar besetzt ein sp2-Hybridorbital des Sauerstoffs, liegt in der Ringebene und trägt damit nicht zum π-System bei (analog zur Elektronenstruktur des Pyridins).
Benzolderivate
- Phenol C6H5–OH
- Nitrobenzol C6H5–NO2
- Anilin (Aminobenzol) C6H5–NH2
- Hydrochinon HO–C6H4–OH
- Pikrinsäure (2,4,6-Trinitrophenol) C6H2(OH)(NO2)3
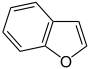
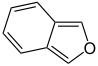
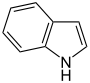
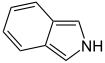
Heteroaromaten
- Furan C4H4O (Fünfring mit Sauerstoffatom)
- Thiophen C4H4S (Fünfring mit Schwefelatom)
- Pyridin C5H5N (Sechsring mit Stickstoffatom)
- Pyrrol C4H4NH (Fünfring mit Stickstoff- und Wasserstoffatom)
Halogenaromaten
- Chlorbenzol C6H5–Cl
- Bromphenole Br–C6H4–OH
Antiaromaten
| |||||
Als Antiaromaten bezeichnet man Stoffe, die die ersten drei Bedingungen eines Aromaten erfüllen (cyclisch, planar, konjugierte Doppelbindungen), statt 4n+2 π-Elektronen jedoch 4n π-Elektronen besitzen. Antiaromaten besitzen nach der Hückel-Näherung ungünstige Energieniveaus. Der einfachste Antiaromat, Cyclobutadien, ist nur bei sehr tiefer Temperatur (≤ 20 K) in einer festen Matrix beständig. Tri-tert-butylcyclopentadien ist hingegen einige Stunden bei 20 °C beständig. Interessanterweise ist Cyclobutadien in der Organometallchemie als Ligand stabil, ein Beispiel ist der Komplex Cyclobutadien-eisentricarbonyl.
Cyclooctatetraen besitzt 8 π-Elektronen. Es liegt jedoch nicht planar vor, sodass die Doppelbindungen nicht konjugiert sind. Die Hückel-Regel kann also nicht angewandt werden. Damit ist 1,3,5,7-Cyclooctatetraen ein Nichtaromat.
Antiaromaten sind eine Teilmenge der nichtaromatischen alicyclischen Verbindungen. Letztere schließen zusätzlich auch nichtkonjugierte Verbindungen ein.
Möbius-Aromaten
Die 1964 von Edgar Heilbronner vorhergesagte Möbius-Aromatizität setzt voraus, dass in einem cyclisch-konjugierten System die besetzten pπ-Orbitale als Möbiusband angeordnet sind, d. h. mit einer 180°-Drehung. Zusätzlich sind die π–Orbitale mit 4n Elektronen besetzt (wobei n hier eine natürliche Zahl ist). Möbius-Aromaten sind durch die Verdrehung chiral. Heilbronner zog nun den Schluss, dass Möbius-Systeme niemals niedriger in der Energie sein können als die entsprechenden Hückel-Pendants. Das Problem bei ihm war, dass er eine Drehung nur für die Berechnung der Möbius-Moleküle, aber nicht für die hückelschen, annahm. Ein Jahr später hatte Zimmerman das Problem genauer behandelt.
Aromaten in der Natur
Viele Verbindungen der Natur besitzen aromatische Strukturen. Allgegenwärtig sind in Proteinen die Aminosäuren wie Tyrosin, Tryptophan oder Phenylalanin. Die DNA oder RNA, die Träger der genetischen Informationen, enthalten die Nukleinbase Adenin als Teil des Nukleotids ATP. Pflanzenfarbstoffe wie die wasserlöslichen Flavonoide, der Gerüststoff Lignin des Holzes, Kofaktoren von Enzymen wie Pyridoxalphosphat oder Pterine sind nur einige weitere Beispiele.
In den natürlichen weiblichen Sexualhormonen Estradiol, Estriol und Estron ist der Ring A des Steroidgerüstes aromatisch. Hingegen ist der Ring A bei den männlichen Sexualhormonen (Androgene) nicht aromatisch.
Die biochemische Synthese und der Abbau von Aromaten ist häufig durch spezielle Enzyme realisiert. Durch den Aromatenabbau werden von Mikroorganismen auch Aromaten der unbelebten Natur, wie Schadstoffe, Pestizide oder Abfälle der chemischen Industrie, in den Kohlenstoffkreislauf zurückgeführt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.09. 2025