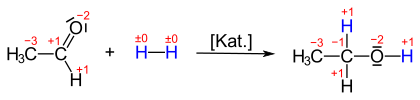Reduktion (Chemie)
Eine Reduktion ist eine chemische Reaktion, bei der ein Ion oder ein Atom als solches oder als Bestandteil eines Moleküls ein oder mehrere Elektronen aufnimmt und dadurch seinen Oxidationszustand verringert. Die Senkung des Oxidationszustandes wird formal durch die Verringerung der sog. Oxidationszahl desjenigen Atoms im Molekül kenntlich gemacht, das für die Reduktion verantwortlich ist. Die Senkung der Oxidationszahl entspricht der Anzahl der aufgenommenen Elektronen. Als Reduktionsmittel bezeichnet man die Substanz, das Atom, das Ion oder das Molekül, das die Elektronen abgegeben hat und dadurch oxidiert wird. Beide gekoppelten Reaktionen werden als die zwei Teilreaktionen der ablaufenden Redoxreaktion bezeichnet.
Geschichte
In der Frühzeit der Chemie wurde die Reduktion als ein Entzug von Sauerstoff aus einem Oxid betrachtet. Als Reduktion (von lat. reductio für „Zurückführung“) wurde damit eine Reaktion bezeichnet, bei der eine Oxidation rückgängig gemacht wurde. Als Oxidation wurde die Vereinigung einer Verbindung oder eines Elements mit Sauerstoff definiert, was auf den Erkenntnissen von Antoine Laurent de Lavoisier beruhte.
Oxide edler Metalle, wie Silber(I)-oxid, zerfallen beim bloßen Erhitzen. Aus Silber(I)-oxid bildet sich Sauerstoff und elementares Silber.
Wird Kupfer(II)-oxid im Wasserstoffstrom erhitzt, so entsteht metallisches Kupfer und Wasser. Wasserstoff wirkt hier als Reduktionsmittel und entzieht dem Kupfer(II)-oxid Sauerstoff.
Entsprechend entsteht bei Eisen(III)-oxid metallisches Eisen und Wasser und der Sauerstoff wird dem Eisen(III)-oxid entzogen.
Heute gilt eine breitere Sichtweise, die nicht auf Reaktionen von sauerstoffhaltigen Verbindungen begrenzt ist und die klassische Betrachtung integriert hat.
Allgemeine Definition
Reduktion ist eine Reaktion bei der ein ein- oder mehratomiges Teilchen Ox ein oder mehrere Elektronen aufnimmt. Dabei bildet sich das Teilchen Red:
Ox reagiert als Elektronenakzeptor, Ox und Red bilden ein sogenanntes Redox-Paar. Die Elektronen stammen von einem zweiten Redox-Paar bei dem eine Oxidation erfolgt. Während im Bereich der Elektrochemie, wie bei einer Elektrolyse oder einer Galvanischen Zelle, der Elektronentransfer zwischen den zwei Redox-Paaren eine messbare Größe ist, lässt sich in anderen Fällen die Reduktion nur über die damit verbundene Erniedrigung der Oxidationszahl von Ox erkennen.
Betrachtet man eine Reduktion als Gleichgewichtsreaktion, ist die Rückreaktion eine Oxidation. Solche Gleichgewichte liegen beispielsweise in einem nicht genutzten Akkumulator vor. Während beim Entladen die Teilreaktion in die eine Richtung verläuft, führt das Laden zu einer Umkehrung der Reaktionsrichtung.
Obwohl eine Reduktion nie ohne Oxidation erfolgt und daher eine Redoxreaktion vorliegt, wird oft eine Reaktion aus der Perspektive des gewünschten Produkts betrachtet. So wird von Reduktion von Eisenerz zum elementaren Eisen oder einer kathodischen Reduktion von Aluminiumoxid zu Aluminium gesprochen.
Aufnahme von Elektronen – Verringerung der Oxidationszahl

Wird ein Eisennagel in eine wässrige Kupfer(II)-sulfatlösung gestellt, bildet sich ein rotbrauner Belag von metallischem Kupfer auf dem Nagel. Das Kupfer wird dabei reduziert, das Eisen zu Fe2+-Ionen oxidiert.
Das Eisen, das während der Redoxreaktion selbst oxidiert wird, nennt man in diesem Zusammenhang auch Reduktionsmittel, weil seine Anwesenheit die Reduktion des Kupfers erst ermöglicht. Reduktion bedeutet dabei immer ein Absinken der Oxidationszahl durch Aufnahme von Elektronen. Oxidation bedeutet dagegen die Abgabe von Elektronen und somit eine Erhöhung der Oxidationszahl. In diesem Fall entsprechen die Ladungen der Teilchen ihrer Oxidationszahl.
Die thermische Zersetzung von Silber(I)-oxid mit den Oxidationsstufen
ist auch eine Reaktion, bei der Elektronen übertragen werden.
Bei der Umsetzung von Kupferoxid mit Wasserstoff wird Kupfer reduziert. Als
Reduktionsmittel agiert hier Wasserstoff. Die Oxidationsstufe der
Sauerstoffatome bleibt in der Reaktion unverändert, die Atome wechseln jedoch
ihren Bindungspartner. Die formal
entstehenden H+-Ionen kombinieren mit den formal unverändert
vorhandenen O2−-Ionen zum Reaktionsprodukt Wasser mit den
Oxidationsstufen .
Entsprechend wird bei der Umsetzung von Eisen(III)-Oxid mit Wasserstoff Eisen reduziert.
Addition von Wasserstoff
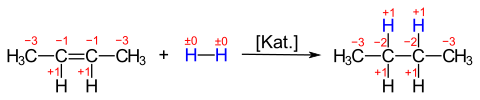
Eine Aufnahme von Wasserstoff durch organische Verbindungen führt zu einer Verringerung der Oxidationszahl eines oder mehrerer Kohlenstoffatome. Die katalytische Hydrierung von 2-Buten führt zu Butan:
Die Oxidationszahlen der ehemals durch Doppelbindung verknüpfte Kohlenstoffatome ändern sich von −1 auf −2. Formal haben diese Atome je ein Elektron und je ein Proton aufgenommen. Das 2. Redox-Paar mit dem Reduktionsmittel H2 kann so formuliert werden:
In dieser Reaktion wird Wasserstoff formal oxidiert und die Elektronen formal freigesetzt. Die Gesamtreaktion ist eine Redoxreaktion, aus der Perspektive des Edukts 2-Buten erfolgt eine Reduktion der Verbindung zu Butan. Oft wird diese Reaktion als Additionsreaktion betrachtet. Aus diesem Blickwinkel sind die Änderungen von Oxidationsstufen irrelevant.
Häufiger wird im Zusammenhang mit sauerstoffhaltigen, organischen Verbindungen von Reduktion gesprochen, wie beispielsweise der Umsetzung von Ketonen oder Aldehyden zu Alkoholen. Nimmt Acetaldehyd Wasserstoff auf, so entsteht Ethanol. Dabei ändert sich die Oxidationsstufe der Carbonylgruppe von +1 nach −1:
Reduktionen sind in der Biochemie wichtig. In vielen Stoffwechselwegen einer Zelle findet eine Reduktion durch Übertragung von Wasserstoff statt. Coenzyme wie NADH, NADPH oder FADH sind befähigt, formal ein Hydridion oder Wasserstoff auf eine andere Verbindung zu übertragen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.03. 2025