Silber(I)-oxid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | 0,01 mg/m3 | ||||||||
| Toxikologische Daten | 2820 mg/kg (LD50, Ratte, oral) | ||||||||
Silber(I)-oxid (Ag2O) ist eine chemische Verbindung aus der Gruppe der Oxide.
| Kristallstruktur | |
|---|---|
-oxid.png) | |
| _ Ag+ _ O2− | |
| Allgemeines | |
| Name | Silber(I)-oxid |
| Andere Namen |
|
| Verhältnisformel | Ag2O |
| Kurzbeschreibung | schweres, fast schwarzes, samtartiges Pulver |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 20667-12-3 |
| EG-Nummer | 243-957-1 |
| ECHA-InfoCard | 100.039.946 |
| PubChem | 9794626 |
| ChemSpider | 7970393 |
| DrugBank | DB15668 |
| Eigenschaften | |
| Molare Masse | 231,74 g/mol |
| Aggregatzustand | fest |
| Dichte | 7,2 g/cm3 (20 °C) |
| Schmelzpunkt | 130 °C (Zersetzung) |
| Löslichkeit | praktisch unlöslich in Wasser |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −31,1 kJ/mol |
Gewinnung und Darstellung
Silber(I)-oxid ist das Reaktionsprodukt des Edelmetalls Silber mit Sauerstoff.
Zur Gewinnung gießt man Silbernitrat-Lösung zu Natronlauge oder Kalilauge. Silberoxid fällt dann im Alkalischen als brauner Niederschlag aus:
Eigenschaften
Silber(I)-oxid ist ein braunes Pulver, das bei Einwirkung von Sonnenlicht nachdunkelt. Feuchtes Silber(I)-oxid ist sehr wenig lichtempfindlich und zersetzt sich beim Trocknen etwas. Es besitzt eine Kristallstruktur vom Cu2O-Typ mit der Raumgruppe Pn3m (Raumgruppen-Nr. 224) (a = 475,2 pm) und eine Bildungsenthalpie von −30,5 kJ/mol. Aufschlämmungen von Silberoxid in Wasser reagieren deutlich alkalisch, da in Umkehrung der obigen Reaktion Silber- und Hydroxidionen gebildet werden.
In Umkehrung der Synthesereaktion wird Silber(I)-oxid beim Erhitzen wieder in die Elemente Silber und Sauerstoff zersetzt (Thermolyse).
An der Luft reagiert Silber(I)-oxid mit Kohlenstoffdioxid zu Silbercarbonat:
Verwendung
In der präparativen organischen Chemie wird Silber(I)-oxid in einer Variante der Williamson-Ethersynthese verwendet.
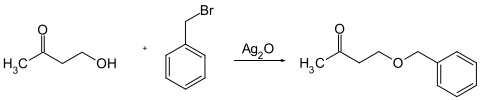
Silber(I)-oxid ist in Wärmeleitpaste zur Weiterleitung der Prozessorwärme an den Kühlkörpern im Computer enthalten, da es eine hohe Wärmeleitfähigkeit besitzt.
Silber(I)-oxid ist Bestandteil der Silberoxid-Zink-Batterie, die in Armbanduhren und anderen Kleingeräten eingesetzt wird.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.02. 2024


