Silber
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Silber ist ein chemisches Elementmit dem Elementsymbol Ag und der Ordnungszahl 47. Es zählt zu den Übergangsmetallen, im Periodensystemsteht es in der 5. Periode und der 1. Nebengruppe (Gruppe 11) oder Kupfergruppe. Das Elementsymbol Ag leitet sich vom lateinischen Wort argentum für "Silber" ab. Silber ist ein Edelmetall.
Es ist ein weiches, gut verformbares (duktiles) Schwermetall mit der höchsten elektrischen Leitfähigkeit aller Elemente und der höchsten thermischen Leitfähigkeit aller Metalle. Lediglich Supraflüssigkeiten und ungestörte kristalline Ausprägungen des Kohlenstoffs (Diamant, Graphen und graphennaher Graphit, Kohlenstoffnanoröhren) und des Bornitrids weisen eine bessere thermische Leitfähigkeit auf.
Etymologie
Das Wort "Silber" leitet sich über das althochdeutsche silabar aus der gemeingermanischen Wurzel *silubra- ab. Aus dieser Wurzel leiten sich auch die Bezeichnungen in den anderen germanischen (engl. silver), den baltischen (litauisch sidabras) und slawischen Sprachen (russisch серебро) sowie das baskische zilar ab. Letztlich ist das Etymon aber wohl nicht germanischen Ursprungs, sondern einer orientalischen Sprache entlehnt. Die Philologie des 19. Jahrhunderts brachte eine Vielzahl von Theorien über den Ursprung des Wortes hervor. Der bis heute häufig zu lesende Zusammenhang mit dem in Homers Ilias beschriebenen sagenhaften Land Alybē (Ἀλύβη), 1870 von Victor Hehn hergestellt, muss Spekulation bleiben. Wahrscheinlicher ist eine Ableitung von der semitischen Wurzel ṢRP (vgl. akkadisch ṣarāpu, "veredeln, legieren").
In den meisten anderen indoeuropäischen Sprachen geht das Wort für Silber auf die genuin indogermanische Wurzel *arg zurück, so griechisch argyros (ἄργυρος) und lat. argentum. Wegen seiner Vorkommen von Silbererzen erhielt Argentinien seinen Namen; es ist das einzige nach einem chemischen Element benannte Land. Häufiger ist die Namensgebung eines Elementes nach einem Land, z.B. Francium, Germanium und Polonium.
| Allgemein | |
|---|---|
| Name, Symbol, Ordnungszahl | Silber, Ag, 47 |
| Serie | Übergangsmetalle |
| Gruppe, Periode, Block | 11, 5, d |
| Aussehen | weißglänzend, metallisch |
| CAS-Nummer | 7440-22-4 |
| ATC-Code | D08AL30 |
| Massenanteil an der Erdhülle | 0,079 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Kristallstruktur | kubisch flächenzentriert |
| Dichte | 10,49 g/cm3 (20 °C) |
| Mohshärte | 2,5 bis 3 |
| Magnetismus | diamagnetisch
(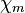 = -2,4 · 10-5)
= -2,4 · 10-5) |
| Schmelzpunkt | 1234,93 K (961,78 °C) |
| Siedepunkt | 2483 K (2210 °C) |
| Molares Volumen | 10,27 · 10-6 m3/mol |
| Verdampfungswärme | 254 kJ/mol |
| Schmelzwärme | 11,3 kJ/mol |
| Schallgeschwindigkeit | 2600 m/s |
| Spezifische Wärmekapazität | 235 (25 °C, Druck konst.) J/(kg · K) |
| Elektrische Leitfähigkeit | 61,35 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 430 W/(m · K) |
| Chemisch | |
| Oxidationszustände | +1, +2, +3 |
| Oxide (Basizität) | Ag2O, Ag2O2 (amphoter) |
| Normalpotential | 0,7991 V (Ag+ + e− → Ag) |
| Elektronegativität | 1,93 (Pauling-Skala) |
Geschichte
Silber wird von Menschen etwa seit dem 5. Jahrtausend v. Chr. verarbeitet. Es wurde zum Beispiel von den Assyrern, den Goten, den Griechen, den Römern benutzt. Zeitweise galt es als wertvoller als Gold. Das Silber stammte meistens aus den Minen in Laurion, die etwa 50 Kilometer südlich von Athen lagen. Bei den alten Ägyptern war Silber als Mondmetall bekannt.
Im Mittelalter und der Frühen Neuzeit wurden in Zentraleuropa Silbererzvorkommen im Harz (Goslar), Thüringer Wald (Ohrdruf), Erzgebirge ( Jáchymov), im Südschwarzwald (Schauinsland), Böhmen (Kutná Hora). Ergiebige Silbervorkommen sind darüber hinaus aus Kongsberg (Norwegen) bekannt.
Später brachten die Spanier große Mengen von Silber aus Lateinamerika, unter anderem aus der sagenumwobenen Mine von Potosí, nach Europa. Auch Japan war im 16. Jahrhundert Silberexporteur. Durch das gestiegene Angebot sank der Silberwert in der Alten Welt.
Da nach 1870 vorwiegend Gold als Währungsmetall verwendet wurde, verlor das Silber seine wirtschaftliche Bedeutung immer mehr. Das Wertverhältnis sank von 1:14 einige Zeit lang auf 1:100, später stieg es wieder etwas an. Im Februar 2012 lag es bei ungefähr 1:51. Das Angebot an Silber ist von der Verbrauchs- und Produktionsentwicklung anderer Metalle abhängig.
Mitte des 19. Jahrhunderts wurde rostfreier Stahl entwickelt, der dann aufgrund seiner Gebrauchsfreundlichkeit und des attraktiven Preises nach dem Ersten Weltkrieg in die Einsatzbereiche des Silbers vordrang, etwa Servierplatten, Bestecke, Leuchter und Küchengerät. Gegenläufig dazu hat sich der Bereich Fotografie und Fotochemie unter Verwendung der Silbersalze während des ganzen 20. Jahrhunderts breit entwickelt, verliert aber seit Ende der 1990er Jahre im Zuge der Umstellung auf die digitale Abbildungstechnik wieder an Bedeutung.
Silber wird zunehmend im Bereich Elektrik/Elektronik sowie zur Kontrolle von Mikroben eingesetzt. Durch den zukünftig verstärkten Einsatz von RFID-Chips wird die Nachfrage weiter ansteigen, da die Funkantennen der Chips aus Silber bestehen. Auch die Kontakte an der Oberseite von Solarzellen werden heute aus Silber gefertigt.
Durch diese zum Teil neuartige Entwicklung ist die Silbernachfrage weltweit weiter steigend.
Silber als Mineral und Varietäten


Silber ist ein seltenes Element, das mit einem Anteil von etwa 0,079 ppm (entsprechend 0,0000079 Prozent) in der Erdkruste vorkommt. Es ist damit etwa 20 mal häufiger als Gold und rund 700 mal seltener als Kupfer. In der Natur tritt es gediegen auf, das heißt elementar; meist in Form von Körnern, seltener von größeren Nuggets, dünnen Plättchen und Blechen oder als drahtig verästeltes Geflecht (Dendrit) bzw. als dünne Silberdrähte in hydrothermal gebildeten Erzgängen sowie im Bereich der Zementationszone.
Von der International Mineralogical Association (IMA) ist es daher in der Strunz'schen Mineralsystematik unter der System-Nr. 1.AA.05 als Mineral anerkannt.
Neben gediegen Silber, das in der Natur bisher (Stand: 2011) an rund 4300 Fundorten nachgewiesen werden konnte, findet man es vor allem in sulfidischen Mineralen. Zu den wichtigsten sulfidischen Silbererzen zählen unter anderem Akanthit (Silberglanz) Ag2S mit einem Silbergehalt von etwa 87 % und Stromeyerit (Kupfersilberglanz) CuAgS mit etwa 53 % Silberanteil. Das Mineral mit dem höchsten Silberanteil von maximal 99 % ist allerdings das selten vorkommende Allargentum. Ebenfalls selten vorkommende Silberminerale sind unter anderem der Chlorargyrit (veraltet Hornerz bzw. Silberhornerz) AgCl und der Miargyrit (Silberantimonglanz) AgSbS2. Insgesamt sind einschließlich gediegen Silber bisher (Stand: 2010) 167 Silberminerale bekannt.
Neben diesen Silbererzen findet man noch sogenannte silberhaltige Erze, die meist nur geringe Mengen Silber (0,01-1 %) enthalten. Dies sind häufig Bleiglanz (PbS) und Kupferkies (CuFeS2). Aus diesem Grund wird Silber häufig als Nebenprodukt bei der Blei- oder Kupferherstellung gewonnen.
Ein als Kongsbergit bezeichnetes Silberamalgam mit einem Quecksilbergehalt von etwa 5 % wird als Varietät dem Silber zugerechnet. Nachgewiesen werden konnte Kongsbergit bisher an 35 Fundorten.
Eine Silbervarietät mit einem Gehalt zwischen 10 und 30 ;% Goldist unter der Bezeichnung Küstelit bekannt und konnte bisher (Stand: 2011) an rund 60 Fundorten nachgewiesen werden.
Seit dem 18. Jahrhundert ist bekannt, dass durch Erhitzen von Akanthit bzw. bei Verhüttungsprozessen von Silbererzen künstlich (anthropogen) erzeugte Silberdrähte, meist in Form von Silberlocken entstehen können. Besonders in den letzten Jahrzehnten wurde wiederholt über die künstliche Erzeugung von Silberlocken auf Akanthitstufen in der Fachliteratur berichtet.
Vorkommen und Förderung
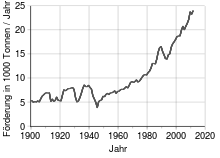
Die wichtigsten Silbervorkommen befinden sich in Nordamerika (Mexiko, den USA und Kanada) und in Südamerika (Peru, Bolivien). Mit rund 30% der globalen Förderung war Peru 2009 der weltweit größte Silberproduzent. Im Jahr 2011 förderte Mexiko mit 4.500 t weltweit das meiste Silber. China konnte seine Produktion in den letzten 3 Jahren um mehr als 50 % steigern.
Das meiste Silber wird aber aus Silbererzen gewonnen, die oft zusammen mit Blei-, Kupfer- und Zinkerzen als Sulfide oder Oxide vorkommen. Wichtige Fundorte von gediegenem Silber waren: Freiberg im Erzgebirge; Schwaz (Tirol); Kongsberg/Norwegen (dort auch große Kristalle); Sankt Andreasberg im Harz; Keweenaw-Halbinsel/USA (dort mit gediegenem Kupfer als "halfbreed"); Batopilas/Mexiko; Mansfelder Kupferschiefer-Revier (Eisleben, Sangerhausen; meist Silberbleche; auch als Versteinerungsmaterial von Fossilien).
Zwischen dem Beginn des 20. Jahrhunderts und dem Ende des Zweiten Weltkrieges hat die jährlich geförderte Silbermenge zwar fluktuiert, ist aber ziemlich konstant geblieben. Nach Kriegsende hat sich die Fördermenge bis heute mehr als verdoppelt.
Das polnische Unternehmen KGHM ist mit durchschnittlich 1.200 Tonnen Jahresförderung das bedeutendste Silberunternehmen der EU und das zweitgrößte weltweit.
Laut einer Studie des Rheinisch-Westflischen Instituts für Wirtschaftsforschung, des Fraunhofer-Instituts für System- und Innovationsforschung sowie der Bundesanstalt für Geowissenschaften und Rohstoffe beträgt die weltweite Reichweite der Silberressourcen nur noch 29 Jahre. Somit ist mit einer Verknappung von Silber in den nächsten Jahrzehnten zu rechnen. Allerdings wird auch immer mehr Silber recycelt, wodurch die bekannten Vorkommen geschont werden. Ausgehend von den Daten des U.S. Geological Survey vom Januar 2013 ergibt sich in Bezug auf Reserven im Verhältnis zu den weltweiten Produktionszahlen von 2011 und 2012 eine aktuelle Reichweite (statische Reichweite) für Silber von 22 bis 23 Jahren (ohne Substitute und Recycling).
| Rang | Land | Fördermengen (in t) |
|---|---|---|
| 1 | Mexiko | 4.150 |
| 2 | China | 3.700 |
| 3 | Peru | 3.410 |
| 4 | Australien | 1.730 |
| 5 | Russland | 1.350 |
| 6 | Chile | 1.290 |
| 7 | Bolivien | 1.210 |
| 8 | Polen | 1.170 |
| 9 | USA | 1.120 |
| 10 | Kanada | 572 |
| alle Übrigen | 3.600 | |
| Gesamtmenge | 23.300 |
Wie bei den anderen Edelmetallen spielt die Wiederaufarbeitung silberhaltiger Materialien im Rahmen des Recyclings, beispielsweise von Fotopapieren, Röntgenfilmen, Entwickler- und Fixierbädern, Elektronikschrott und Batterien eine wichtige Rolle.
Gewinnung und Darstellung
Gewinnung aus Silbererzen
20 % des Silbers wird aus Silbererzen gewonnen. Aus diesen wird das Silber meist durch Cyanidlaugung mit Hilfe einer 0,1%igen Natriumcyanid-Lösung herausgelöst. Dazu wird das Erz zunächst fein zu einem Schlamm zerkleinert. Anschließend wird die Natriumcyanid-Lösung dazugegeben. Dabei ist eine gute Belüftung wichtig, da für das Verfahren Sauerstoff benötigt wird.
Bei der Zugabe von Natriumcyanid gehen sowohl elementares Silber als auch Silbererze (Ag2S, AgCl) als Dicyanoargentat(I) [Ag(CN)2]− in Lösung:
,
,
Da die Reaktion von Natriumcyanid mit Silbersulfid in einem Gleichgewicht steht, muss das Natriumsulfid entweder durch Oxidation mit Sauerstoff oder durch Fällung (z.B. als Bleisulfid) entfernt werden. Anschließend fällt man das edlere Silber – ähnlich wie bei der Goldgewinnung – mit Zink aus:
.
Das ausgefallene Rohsilber (Werksilber) wird abgefiltert und weiter gereinigt.
Gewinnung aus Bleierzen
Bei der Gewinnung von Bleierzen, z.B. aus Bleiglanz, entsteht nach dem Rösten und Reduzieren das sogenannte Rohblei oder Werkblei . Dieses enthält meist noch einen Anteil Silber (zwischen 0,01 und 1 %). Im nächsten Schritt wird nun das Edelmetall entfernt und so dieses wertvolle Nebenprodukt gewonnen.
Zur Gewinnung muss zunächst das Silber vom größten Teil des Bleis getrennt werden. Dies geschieht durch das Verfahren des Parkesierens (nach Alexander Parkes, der dieses Verfahren 1842 erfand). Das Verfahren beruht auf der unterschiedlichen Löslichkeit von Silber und Blei in Zink. Bei Temperaturen bis 400 °C sind Blei (flüssig) und Zink (fest) praktisch nicht mischbar. Zunächst wird bei Temperaturen > 400 °C zum geschmolzenen Blei Zink gegeben. Danach wird die Mischung abgekühlt. Da Silber im geschmolzenen Zink leicht löslich ist, geht es in die Zinkphase über. Anschließend erstarrt die Zinkschmelze als so genannter Zinkschaum (Zink-Silber-Mischkristalle). Dadurch kann das Silber vom größten Teil des Bleis getrennt werden. Dieser Zinkschaum wird auch als Armblei bezeichnet. Er wird anschließend bis zum Schmelzpunkt des Bleis (327 °C) erhitzt, so dass ein Teil des Bleis schmilzt und entfernt werden kann. Danach wird die verbliebene Zink-Blei-Silber-Schmelze bis zum Siedepunkt des Zinks (908 °C) erhitzt und das Zink abdestilliert. Das so gewonnene Produkt wird Reichblei genannt und enthält etwa 8-12 % Silber.
Um das Silber anzureichern, wird nun die sogenannte Treibarbeit (Läuterung) durchgeführt. Dazu wird das Reichblei in einem Treibofen geschmolzen. Dann wird ein Luftstrom durch die Schmelze geleitet. Dabei oxidiert das Blei zu Bleioxid, das edle Silber bleibt hingegen unverändert. Das Bleioxid wird laufend abgeleitet und so nach und nach das Blei entfernt. Ist der Bleigehalt des Raffinats so weit gesunken, dass sich auf der Oberfläche der Metallschmelze keine matte Bleioxidschicht mehr bildet, das letzte Oxidhäutchen aufreißt und mithin das darunterliegende glänzende Silber sichtbar werden lässt, spricht man vom Silberblick. Die dann vorliegende Legierung wird Blicksilber genannt und besteht zu über 95 % aus Silber.
Gewinnung aus Kupfererzen
Silber ist auch in Kupfererzen enthalten. Bei der Kupferherstellung fällt das Silber — neben anderen Edelmetallen — im so genannten Anodenschlamm an. Dieser wird zunächst mit Schwefelsäure und Luft vom Großteil des noch vorhandenen Kupfers befreit. Anschließend wird er im Ofen oxidierend geschmolzen, wobei enthaltene unedle Metalle in die Schlacke gehen und entfernt werden können.
Raffination

Rohsilber wird auf elektrolytischem Weg im sogenannten Möbius-Verfahren gereinigt. Dazu wird das Rohsilber als Anode in eine Elektrolysezelle geschaltet. Als Kathode dient ein Feinsilberblech, als Elektrolyt salpetersaure Silbernitratlösung.
Das Verfahren entspricht der elektrolytischen Reinigung des Kupfers. Während der Elektrolyse werden Silber und alle unedleren Bestandteile des Rohsilbers (beispielsweise Kupfer oder Blei) oxidiert und gehen in Lösung. Edlere Anteile wie Gold und Platin können nicht oxidiert werden und fallen unter die Elektrode. Dort bilden sie den Anodenschlamm, der eine wichtige Quelle für Gold und andere Edelmetalle ist. An der Kathode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber.
Eigenschaften
Physikalische Eigenschaften
Silber ist ein weißglänzendes Edelmetall. Das Metall kristallisiert im kubischen-flächenzentrierten Kristallsystem. Unter Normaldruck betragen die Schmelztemperatur 961 °C und die Siedetemperatur 2212 °C. Silber hat aber bereits oberhalb von 700 °C, also noch im festen Zustand, einen deutlichen Dampfdruck. Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt eine Dichte von 10,49 g/cm3 (bei 20 °C) und gehört daher wie alle Edelmetalle zu den Schwermetallen.
Silber hat einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 Prozent des sichtbaren Lichtes. Als "weißestes" aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln benutzt. Strichfarbe ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das Reflexionsspektrum zeigt im nahen UV eine ausgeprägte Plasmakante.
Silber leitet von allen Metallen Wärme und Elektrizität am besten. Wegen seiner Dehnbarkeit und Weichheit (Mohshärtevon 2,5-4) lässt es sich zu feinsten, blaugrün durchschimmernden Folien von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge nur 0,1 bis 1 g wiegenden Drähten (Filigrandraht) ausziehen.
Im geschmolzenen Zustand löst reines Silber leicht aus der Luft das 20-fache Volumen an Sauerstoff, der beim Erstarren der Schmelze unter Aufplatzen der bereits erstarrten Oberfläche (Spratzen) wieder entweicht. Bereits gering legiertes Silber zeigt diese Eigenschaft nicht.
Chemische Eigenschaften

Silber ist ein Edelmetall mit einem Normalpotential von +0,7991 V. Aus diesem Grund ist es relativ reaktionsträge. Es reagiert auch bei höherer Temperatur nicht mit dem Sauerstoff der Luft. Da in der Luft spurenweise Schwefelwasserstoff H2S enthalten ist, laufen Silberoberflächen allerdings mit der Zeit schwarz an, da elementares Silber mit Schwefelwasserstoff in Anwesenheit von Luftsauerstoff Silbersulfid (Ag2S) bildet:
.
Silber löst sich nur in oxidierenden Säuren, wie beispielsweise Salpetersäure. In nichtoxidierenden Säuren ist es nicht löslich. Auch in Cyanid-Lösungen löst es sich bei Anwesenheit von Sauerstoff durch die Bildung eines sehr stabilen Silbercyanid-Komplexes, wodurch das elektrochemische Potential stark verschoben ist. In konzentrierter Schwefel- und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch Silbernitrat und -sulfat passiviert ist. Silber ist stabil gegen geschmolzene Alkalihydroxide wie Natriumhydroxid. Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel.
Biologisch-medizinische Eigenschaften
Silber wirkt in feinstverteilter Form bakterizid, also schwach toxisch, was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an Schwefel gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches Silbersulfid aus. Die Wirkung ist oberflächenabhängig. Dies wird in der Medizin genutzt für Wundauflagen wie für invasive Geräte (z.B. endotracheale Tuben). In der Regel wird Silber für bakterizide Zwecke daher in Medizinprodukten als Beschichtung oder in kolloidaler Form eingesetzt, zunehmend auch Nanosilber. Silberionen finden als Desinfektionsmittel und als Therapeutikum in der Wundtherapie Verwendung. Sie können silberempfindliche Erreger nach relativ langer Einwirkzeit reversibel inhibieren, können darüber hinaus bakteriostatisch oder sogar bakterizid (also abtötend) wirken. Man spricht hier vom oligodynamischen Effekt. In manchen Fällen werden Chlorverbindungen zugesetzt, um die geringe Wirksamkeit des Silbers zu erhöhen.
Dabei kommen verschiedene Wirkmechanismen zum Einsatz:
- Blockierung von Enzymenund Unterbindung deren lebensnotwendiger Transportfunktionen in der Zelle,
- Beeinträchtigung der Zellstrukturfestigkeit,
- Schädigung der Membranstruktur.
Die beschriebenen Effekte können zum Zelltod führen.
Neben der Argyrie, einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Köörper außerdem zu Geschmacksstörungen, Geruchsunempfindlichkeit sowie zerebralen Krampfanfällen kommen.
Umstritten ist die therapeutische Einnahme von kolloidalem Silber, das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universalantibiotikum angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei peroraler Verabreichung stark anzuzweifeln. Sehr geringe oral aufgenommene Mengen bis 5 Mikrogramm Silber pro Kilogramm Körpergewicht und Tag sollen nach Ansicht der amerikanischen Umweltschutzbehörde EPA zu keiner Vergiftung führen.
Verwendung

Silberpreis
Der Preis des Silbers wird auf dem offenen Markt bestimmt. Das geschieht seit dem 17. Jahrhundert am London Bullion Market. Die Einführung des Silberfixings 1897 in London markiert den Beginn der Marktstruktur. 1987 wurde die London Bullion Market Association (LBMA) gegründet. Drei LBMA-Mitglieder nehmen am Silberfixing an jedem Arbeitstag unter Vorsitz der Bank of Nova Scotia - ScotiaMocatta teil. Weitere Mitglieder des Silberfixings sind die Deutsche Bank AG London und HSBC Bank USA NA London Branch.
In den 1970er Jahren führte die Silberspekulation der Brüder Hunt zu einem Rekordstand beim Silberpreis. Diese kauften im Zusammenspiel mit vermögenden Geschäftsleuten aus Saudi-Arabien riesige Mengen an Silber sowie Silberkontrakten an den Warenterminbörsen und versuchten, den Silbermarkt zu beherrschen. Am 18. Januar 1980 wurde beim Silberfixing am London Bullion Market ein Rekordstand von 49,45 US-Dollar pro Feinunze ermittelt. Den nächsten Rekord erreichte der Silberpreis erst über 31 Jahre später, am 25. April 2011, als die Feinunze Silber in Hong Kong mit 49,80 US-Dollar gehandelt wurde.> Dem Inflationsrechner des United States Department of Labor zufolge entsprechen 49,45 US-Dollar von 1980 im Jahr 2011 einer Summe von 134,99 US-Dollar.
Für den standardisierten Silberhandel an Rohstoffbörsen wurde - XAG - als eigenes Währungskürzel nach ISO 4217 vergeben. Es bezeichnet den Preis einer Feinunze Silber (31,1 Gramm).
Währung und Wertanlage


Die früher wichtigste Verwendung war die Herstellung von Silbermünzen als Zahlungsmittel. Für Münzen wurde in der Antike und im Mittelalter nur Silber, Gold und Kupferbzw. Bronze verwendet. Der Münzwert entsprach weitgehend dem Metallwert (Kurantmünze). In Deutschland waren bis 1871 Silbermünzen (Taler) vorherrschend, die Währung war durch Silber gedeckt (Silberstandard). Nach 1871 wurde der Silber- durch den Goldstandard abgelöst. Der Grund für die Verwendung dieser Edelmetalle waren die hohe Wertspeicherung (Seltenheit) und Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht (Scheidemünze). Silber wird als Münzmetall heute meist nur noch für Gedenk- und Sondermünzen verwendet.
Besonders in Zeiten von Wirtschaftskrisen — wie z.B. ab 2007 — hat sich neben Gold auch das Edelmetall Silber durch seine Kurs- und Wertstabilität als eine der wichtigsten Anlageform in verschiedensten Ausprägungen wie z.B. Silberbarren, Silberschmuck oder Silbermünzen erwiesen.
Wirtschaft und Sport
Silber ist neben Gold und Edelsteinen (z.B. Diamanten) ein wichtiges Material für die Herstellung von Schmuck. Silber wird seit Jahrhunderten für erlesene und wertbeständige Essbestecke, Tafelsilber und Sakrales Gerät verwendet. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des Feingehaltstempels abgelesen werden.
Silbermedaillen werden bei vielen Sportwettkämpfen, z.B. bei den Olympischen Spielen, als Zeichen für das Erreichen des zweiten Platzes verliehen. Dies kommt daher, dass Silber traditionell nach Gold als nächst edleres Metall gilt. Allerdings wird die Goldmedaille aus 92,5 % Silber hergestellt und mit 6 g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig als "silbern" bezeichnet. Beispiele sind Silberner Bär, Silberner Griffel, Silberner Schuh und Silbernes Lorbeerblatt.
Sehr begehrt ist es auch bei Musikinstrumenten, da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z.B. bei der Querflöte das empfindliche Holz ersetzt.
Silber besitzt die höchste elektrische Leitfähigkeit aller Metalle, eine hohe Wärmeleitfähigkeit und eine ausgeprägte optische Reflexionsfähigkeit. Dadurch ist es für Anwendungen in Elektrik, Elektronik und Optikprädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen Versilberung von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet. Eine Suspension von Silberpulver in Klebstoffen macht sie zu elektrisch (und thermisch) leitfähigen Klebern.
Die Schwärzung der Silberhalogenide infolge ihres Zerfalls durch Licht und Entwicklung wird beim Fotopapier genutzt. Es bildete von etwa 1850 bis zur Verbreitung der Digitaltechnik die Grundlage der Fotografie.
Silberlegierungen (mit Kupfer, Zink, Zinn, Nickel, Indium usw.) werden in der Elektrotechnik und Löttechnik als Lotlegierungen (sogenanntes Hartlöten), Kontaktmaterialien (z.B. in Relais) und Leitmaterial (z.B. als Kondensatorbeläge) verwendet. Silberlegierungen werden aber auch in der Dentaltechnik und im dekorativen Bereich verwendet.
Der früher zum Füllen hohler Silbergefäße verwendete Silberkitt enthält trotz seines Namens kein Silber.
Silbergeschirre und -geräte geben beim Gebrauch immer etwas Silber an die Speisen und Getränke ab, was sich ggf. in einem unangenehmen Metallgeschmack bemerkbar macht. Um dies zu vermeiden, werden silberne z. B. Trinkgefäße oft innen vergoldet. Durch Silbersulfid angelaufenes Silber wird entweder poliert oder chemisch reduziert.
Silber in medizinnahen Anwendungen
Werkstoffe oder Beschichtungsverfahren nutzen die antibakterielle Wirkung von Silber in Medizinprodukten und anderen Anwendungen in Form von Silberbeschichtungen, als kolloidales Silber, Nanosilber oder in Form von Silberfäden. Beispiele in Medizinprodukten:
- Wundauflagen mit kolloidalem Silber oder Nanosilber
- Silberbeschichtungen endoskopischer Tuben
- Kunststoffe mit Silberdotierung zur Anwendung in der Medizintechnik
- Silberhaltige Cremes als Arzneimittel und Kosmetika, z.B. bei Schuppen mit Hautpilzverdacht oder bei Neurodermitis
- Silberplatte als Knochenersatz, typischerweise Schädelknochen
In Bezug auf die medizinische Anwendung von Silber empfiehlt das Bundesinstitut für Risikobewertung (BfR) vorerst generell auf den Einsatz von nanoskaligem Silber oder nanoskaligen Silberverbindungen in verbrauchernahen Produkten zu verzichten.
Beispiele für Hygiene- und andere Anwendungen
- Silberfäden oder Silberionen hemmen in der antimikrobiellen Ausrüstung von Textilien das Wachstum von Bakterien auf der Haut und verhindern damit unangenehme Gerüche.
- Beschichtung von Oberflächen, z.B. in Kühlschränken, auf Küchenmöbeln, Lichtschaltern und anderen Gegenständen
- Antibakterielle Emaillierungen und Keramiken
- Silberbeschichtete Wasserfilterkartuschen
- Beläge von keramischen Kondensatoren für die Elektrotechnik/Elektronik
Silber in der Katalyse
Silberkatalysatoren finden industrielle Anwendung in der Partialoxidation von Ethen zu Ethylenoxid bzw. von Methanol zu Formaldehyd. Durch die Bedeutung des Silbers für die Oxidationskatalyse sind zahlreiche Untersuchungen zur Wechselwirkung von Silberoberflächen mit Sauerstoff durchgeführt worden. Verschiedene Sauerstoffspezies sind an der Silberoberfläche, im oberflächennahen Bereich und im Silbervolumen lokalisiert. Neben Spezies, die auf das Substrat übertragen werden und mehr oder weniger selektiv zur Oxidation eines Moleküls führen, sind auch Zentren vorhanden, die eine katalytische Dehydrierung ermöglichen. Dies ist interessant im Zusammenhang mit der Tatsache, dass die Partialoxidation von Methanol zu Formaldehyd unterstöchiometrische Mengen an Sauerstoff erfordert. Die Bildung der Sauerstoffspezies ist abhängig von der Temperatur, aber auch von der Art der Reaktionsatmosphäre. Bestimmte O-Spezies sind ex situ nicht nachweisbar und stellen hohe Anforderungen an die eingesetzten Charakterisierungsmethoden.
Silber katalysiert anderseits auch die Reduktion organischer Substrate durch Wasserstoff, z.B. die Hydrierung von α,β-ungesättigten Carbonylverbindungen. Die Wechselwirkung von H2 mit Silberkatalysatoren ist — verglichen mit klassischen Hydrierkatalysatoren wie Platin — nur schwach ausgeprägt. Ag-Katalysatoren sind deshalb in der Lage, Doppelbindungen von bi-/multifunktionellen Molekülen selektiv zu hydrieren (z.B. Hydrierung von Acrolein zu Allylalkohol).
Nichtmetallische und nicht bakterizide Silberanwendungen
Silber wird als Lebensmittelfarbstoff E 174 auch im Speisenbereich verwendet, zum Beispiel für Überzüge von Süßwaren wie etwa Pralinen und in Likören. Silbersalze färben Glasund Emaille gelb.
Silberlegierungen
Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold, Kupfer oder Palladium (ein Palladiumgehalt von 20 bis 30 Prozent macht das Silber anlaufbeständig). In begrenztem Umfang lässt sich Silber mit Chrom, Manganoder Nickel legieren. Legieren erhöht zumeist die Härte des Silbers. Mit Cobaltoder Eisenlässt es sich nicht legieren.

Die wichtigsten Silberlegierungen sind heute Kupfer-Silber-Legierungen. Sie werden meist nach ihrem Feingehalt an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 und 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung Pfund Sterling als Sterlingsilber bezeichnet. Es ist die wichtigste Silberlegierung und wird u.a. zur Herstellung von Münzen, Schmuck und Besteck verwendet.
Im Hinblick auf den Export werden heute Korpuswaren vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten gelötet werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von beispielsweise 925/1000 zu genügen. Eine neuartige Legierung aus England ist Argentium™ Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke und Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkaufsfördernde, strahlendweiße Silberfarbe und ein stark vermindertes Anlaufen der Waren erreicht.
Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das Tulasilber, eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch vergoldet, man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann "Vermeil".
Neusilber ist dagegen kein Silber, sondern eine optisch silberähnliche, weiße, unedle Metalllegierung aus Kupfer, Nickel und Zink in veränderlichen Gewichtsanteilen. Eine vor allem bei Bestecken und Gebrauchsgegenständen übliche Bezeichnung für Neusilber ist Alpacca. Als "Tibetsilber" wurde ursprünglich im Handel eine Legierung mit nur geringem (250 Tausendstel) Silberanteil bezeichnet, neuerdings werden vom Schmuckhandel fast sämtliche (versilberte und unversilberte) Zinnlegierungen so bezeichnet. Damit die Ware mit Silber galvanisiert werden kann, wird vorher vernickelt. Silber hingegen ist in diesen Legierungen, die früher Weißmetall, Metall oder Weichgussmetall genannt wurden, nicht enthalten.
Verbindungen
Silber kommt in chemischen Verbindungen hauptsächlich in der Oxidationsstufe +I vor, die Oxidationsstufen +II, +III und +IV sind selten und meist nur in Komplexen stabil.
Oxide
- Silber(I)-oxid Ag2O ist ein dunkelbrauner Feststoff, der aus silberhaltigen Lösungen mit Basen, z.B. Natronlauge, ausfällt. Bei höheren Temperaturen zerfällt Ag2O in die Elemente.
Die Silberoxide mit Silber in Oxidationsstufen größer +I können nur auf elektrochemischem Wege dargestellt werden. Dies sind die Verbindungen Silber(I,III)-oxid AgO, Silber(II,III)-oxid Ag3O4 und Silber(III)-oxid Ag2O3.
Silberhalogenide
Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im Licht und werden deshalb viel in der Fotografie gebraucht. Silberhalogenide sind außer dem Fluorid schwer in Wasser löslich und dienen zum Nachweis von Halogenid-Ionen.
- Silber(I)-fluorid AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht lichtempfindlich.
- Silber(I)-chlorid AgCl ist ein weißes, kristallines wasserunlösliches Pulver. Es dient als Nachweis für Chloridionen. Außerdem wird es in Referenzelektroden und (seltener) in der Fotografie verwendet.
- Silber-I-bromid ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Fotografie.
- Silber(I)-iodid ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Fotografie verwendet. Manchmal wird Silberiodid von Flugzeugen als Kondensationskeim zur Regenbildung versprüht.
- Silber(II)-fluorid AgF2 ist eines der wenigen nicht komplexen zweiwertigen Silbersalze. Es wird als Fluorierungsmittel an Stelle von elementarem Fluor verwendet.
Silberchalkogenide
- Silber(I)-oxid Ag2O ist ein dunkelbrauner Feststoff der aus silberhaltigen Lösungen mit Basen (z.B. Natronlauge) ausfällt. Bei höheren Temperaturen zerfällt Ag2O in die Elemente.
- Silber(I)-sulfid Ag2S ist von allen Silbersalzen am schwersten wasserlöslich. Es ist schwarz und entsteht direkt aus den Elementen oder durch Versetzen silberhaltigen Lösungen mit Schwefelwasserstoff. Wenn Silberbesteck anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid.
Weitere wichtige Silberverbindungen
- Silbernitrat AgNO3 ist die wichtigste Silberverbindung und Ausgangsstoff für die Herstellung der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in Salpetersäure hergestellt.
- Silbersulfat Ag2SO4 entsteht beim Auflösen von Silber in konzentrierter Schwefelsäure.
- Silberazid AgN3 und Silberacetylid Ag2C2 sind hochexplosiv. Ersteres kann als Initialzünder von Sprengstoffen dienen. Das ebenfalls sehr explosive Silberfulminat AgCNO wird auch als Knallsilber bezeichnet.
- Silbercyanid AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt.
Silber in höheren Oxidationsstufen tritt beispielsweise im Tetrapyridinosilber(II)-persulfat - [Ag(C5H5N)4]S2O8, im Kaliumtetrafluoroargentat(III) K[AgF4] oder Caesiumhexafluoroargentat(IV) Cs2[AgF6] auf. Die giftigen Silbercyanide werden u.a. in galvanischen Bädern zur Versilberung und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von Komplexionen ausgeprägt, meist mit der Koordinationszahl 2. Diese Komplexionen sind mit Ausnahme des erst in stark salzsaurer Lösung entstehenden [AgCl2]− nur in alkalischer (basischer) oder neutraler Lösung beständig.
Nachweis

nach Zugabe von Ammoniak (rechts)
Beim Zutropfen von Halogenid-Läsung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z.B.:
- Ag+(aq) + Cl−(aq) → AgCl (s)
Als Nachweisreaktion für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung: Ein weißer Niederschlag von Silberchlorid (löslich in verdünntem Ammoniakwasser, es entsteht der Silberdiamminkomplex [Ag(NH3)2]+ ). Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich komplexe Dichloroargentate(I) bilden:
- AgCl + Cl− → [AgCl2]−
Der Niederschlag ist bei Iodid-Ionen (AgI) gelb-grünlich und in Ammoniakwasser unlöslich, bech Zugabe von Ammoniak (rechts)
Beim Zutropfen von Halogenid-Läsung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z.B.:
- Ag+(aq) + Cl−(aq) → AgCl (s)
Als Nachweisreaktion für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung: Ein weißer Niederschlag von Silberchlorid (löslich in verdünntem Ammoniakwasser, es entsteht der Silberdiamminkomplex [Ag(NH3)2]+ ). Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich komplexe Dichloroargentate(I) bilden:
- AgCl + Cl− → [AgCl2]−
Der Niederschlag ist bei Iodid-Ionen (AgI) gelb-grünlich und in Ammoniakwasser unlöslich, bei Chlorid- und Bromid-Ionen (AgCl, AgBr) weißlich.
Heraldik
In der Heraldik wird Silber, wie auch Gold, als Metall bezeichnet, das zu den heraldischen Tinkturen zählt. Es wird häufig durch weiße Farbe wiedergegeben.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.01. 2023