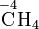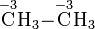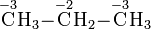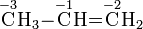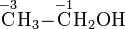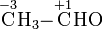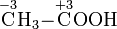Oxidationszahl
Die Oxidationszahl (auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit) gibt die Ionenladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions an, die vorliegen würde, wenn die Verbindung oder das mehratomige Ion aus einatomigen Ionen bestehen würde. Dazu werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen. Bindende Elektronenpaare zwischen gleichen Atomen werden geteilt. Die Atome in Modifikationen der Elemente haben die Oxidationszahl Null. Bei einatomigen Ionen ist die Oxidationszahl gleich der tatsächlichen Ladung. Eine Oxidationszahl ist ein Zahlenwert mit Vorzeichen (+/-).
Die Oxidationszahl ist eine formale Größe und hat oft nur wenig mit einer realen Ladung zu tun. Sie ist jedoch ein wichtiger Formalismus für die Stöchiometrie von Redoxreaktionen.
Nach IUPAC werden die Bezeichnungen oxidation state und oxidation number verwendet. Die Bezeichnung oxidation state entspricht der hier beschriebenen Oxidationszahl. Die oxidation number ist ein Element der Nomenklatur von anorganischen Salzen (z.B. für Eisen(III)-chlorid), komplexen Verbindungen (z.B. für Kaliumhexacyanidoferrat(II)) und komplexen Ionen. In der Nomenklatur von Verbindungen (oxidation number) werden nur ganzzahlige Oxidationszahlen verwendet und neben der Zahl 0 ausschließlich in römischen Zahlen angegeben. Bei komplexen Verbindungen gibt der Wert die Oxidationszahl des Zentralatoms an.
Eine andere Definition lautet: Die Oxidationszahl eines Atoms in einer chemischen Verbindung ist formal ein Maß zur Angabe der Verhältnisse der Elektronendichte um dieses Atom. Eine positive Oxidationszahl zeigt an, dass die Elektronendichte gegenüber seinem Normalzustand verringert ist, eine negative zeigt an, dass die Elektronendichte um das Atom erhöht ist.
Nutzen
Die Oxidationszahlen dienen bei Redoxreaktionen dazu, die Vorgänge besser zu erkennen. Eine Verringerung der Oxidationszahl eines Elements durch eine Redoxreaktion bedeutet, dass dieses Element reduziert wurde, analog bedeutet eine Erhöhung der Oxidationszahl eines Elements, dass dieses oxidiert wurde.
Angabe der Oxidationszahl
Die Oxidationszahlen werden zur Darstellung von Formeln meist als arabische Ziffern angegeben und sind in der Regel ganzzahlig. Im Unterschied zu Ionenladungen werden die Zeichen Plus und Minus vor den Zahlen angegeben. Zur Darstellung von Redoxreaktionen stehen die Oxidationszahlen oberhalb eines Elementsymbols. Gelegentlich werden jedoch auch römische Zahlen verwendet. Die möglichen Oxidationszahlen der chemischen Elemente sind hier gelistet.
-
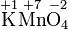
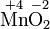
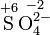
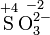
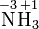
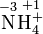
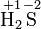
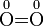
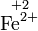
Kaliumper-
manganatMangan-
dioxidSulfat-Ion Sulfit-Ion Ammoniak Ammonium
-IonSchwefel-
wasserstoffSauerstoff Eisen(II)-Ion
Zur Formulierung von Redoxreaktionen werden häufig nur die Oxidationszahlen der an der Reaktion entscheidenden Elemente angegeben:
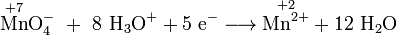
- Teilreaktion einer Redoxreaktion: Reduktion des Oxidationsmittels Permanganat.
Die Oxidationszahlen können auch gebrochene Werte annehmen. Bei Hyperoxiden, wie Kaliumhyperoxid (KO2), haben die Sauerstoffatome die Oxidationszahl -0,5 und unterscheiden sich von den Peroxiden mit der Oxidationszahl -1.
Im Fe3O4 (Eisen(II,III)-oxid) hat Eisen eine durchschnittliche Oxidationszahl von +8/3. Die im Namen in römischen Zahlen aufgeführten Oxidationsstufen deuten darauf hin, dass Eisenatome in dieser Verbindung mit den Oxidationsstufen +2 und +3 vorliegen. (Es liegt nicht die Oxidationsstufe +2,3 vor.) FeIIFe2IIIO4 hat eine inverse Spinellstruktur (Vereinfacht: FeO·Fe2O3) und formale Fe2+- und Fe3+-Ionen können lokalisiert werden.
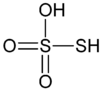
Das Thiosulfat-Ion (S2O32−, Disulfat(II)-Ion) besteht aus zwei ungleichen Schwefelatomen. Die mittlere Oxidationsstufe des Schwefels ist +2. Die diskreten Stufen, die sich aus der Struktur ableiten lassen, sind +5 und -1. Für stöchiometrische Berechnungen der anorganischen Chemie eignen sich die mittleren und die diskreten Oxidationsstufen.
-
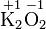
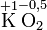
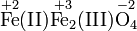
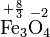
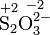
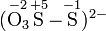
Kalium- peroxid Kalium- hyperoxid Eisen(II,III)-oxid
mit diskreten OxidationsstufenEisen(II,III)-oxid
mit mittlerer OxidationsstufeThiosulfat-Ion
Disulfat(II)-Ion
mit mittlerer OxidationsstufeThiosulfat-Ion
mit diskreten Oxidationsstufen
Bei organischen Verbindungen werden die Oxidationszahlen für jedes Kohlenstoffatom getrennt ermittelt:
Durch den Vergleich von Oxidationszahlen lässt sich beispielsweise erkennen, dass eine Umsetzung eines primären Alkohols zu einem Aldehyd oder die Umsetzung eines Aldehyds zu einer Carbonsäure Oxidationensind.
Bei organischen Reaktionen genügen einfache stöchiometrische Betrachtungen meist nicht, um Reaktion zu beschreiben. Daher spielen Oxidationsstufen im Vergleich zur anorganischen Chemie eine untergeordnete Rolle. Eine stöchiometrisch ablaufende Reaktion ist z.B. die Tollensprobe:
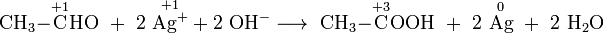
- Oxidation von Acetaldehyd zur Essigsäure
Grundsätzlich ist die Summe der Oxidationszahlen der Atome einer molekularen Verbindung gleich Null. Bei Ionen ist die Summe der Oxidationszahlen gleich der Ionenladung. Bei stöchiometrisch richtig aufgestellten Redoxreaktionen ist die Summe der Oxidationszahlen der Edukte gleich der Summe der Oxidationszahlen der Produkte.
Bestimmung der Oxidationszahl
Hauptregeln
Die Oxidationszahl lässt sich mit Hilfe folgender Regeln herleiten:
- Atome im elementaren Zustand haben immer die Oxidationszahl 0 (z.B. I2, C, O2, P4, S8; 0 ist aber auch in Verbindungen mit anderen Elementen möglich).
- Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung (z.B. Cu2+ hat die Oxidationszahl +2, Ag+ hat die Oxidationszahl +1).
- Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0.
- Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions ist gleich der Gesamtladung dieses Ions.
- Bei kovalent formulierten Verbindungen (so genannten Valenzstrichformeln, Lewis-Formeln) wird die Verbindung formal in Ionen aufgeteilt. Dabei wird angenommen, dass die an einer Bindung beteiligten Elektronen vom elektronegativeren Atom vollständig übernommen werden.
- Die meisten Elemente können in mehreren Oxidationsstufen auftreten.
Hilfsregeln
In der Praxis hat es sich als hilfreich erwiesen, für die Bestimmung der Oxidationszahlen einige Regeln zu formulieren:
- Das Fluoratom(F) als Element mit höchster Elektronegativität bekommt in Verbindungen immer die Oxidationszahl -1.
- Sauerstoffatome bekommen die Oxidationszahl -2. Mit 3 Ausnahmen: In Peroxiden (dann: -1) und in Hyperoxiden (dann -0,5) und in Verbindung mit Fluor (dann: +2).
- Weitere Halogenatome(wie Chlor, Brom, Iod) haben im Allgemeinen die Oxidationszahl (-1), außer in Verbindung mit Sauerstoff oder einem Halogen, das im Periodensystem höher steht.
- Metallatomebekommen in Verbindungen als Ionen immer eine positive Oxidationszahl.
- Alkalimetalle haben stets +1 und Erdalkalimetalle stets +2 als Oxidationszahl.
- Wasserstoffatome bekommen die Oxidationszahl +1, außer wenn Wasserstoff mit "elektropositiveren" Atomen wie Metallen (Hydride) oder sich selbst direkt verbunden ist.
- In ionischen Verbindungen (Salzen) ist die Summe der Oxidationszahlen identisch mit der Ionenladung.
- In kovalenten Verbindungen (Molekülen) werden die Bindungselektronen dem elektronegativeren Bindungspartner zugeteilt. Gleiche Bindungspartner erhalten je die Hälfte der Bindungselektronen. Die Oxidationszahl entspricht somit den zugeteilten Bindungselektronen im Vergleich zu der Anzahl der normalerweise vorhandenen Außenelektronen.
- Die höchstmögliche Oxidationszahl eines Elementes entspricht der Haupt- bzw. Nebengruppenzahl im Periodensystem (PSE)
Bestimmung anhand der Elektronegativität
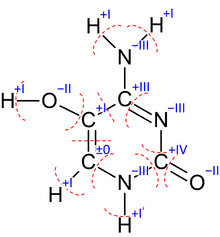
Die Oxidationszahlen lassen sich, wenn eine Lewis-Formel des Moleküls vorliegt, leicht anhand der Elektronegativität der jeweiligen Elemente bestimmen. Man spaltet dazu gedanklich jede Bindung und berechnet, welches Atom die Bindungselektronen dann bekommen würde. Dies ist abhängig von der Elektronegativität; das Atom mit der größeren Elektronegativität erhält die Bindungselektronen. Dadurch ändert sich die Ladung des Atoms, die Ladung entspricht dann der Oxidationszahl. Das Spalten der Bindungen ist dabei nur ein Gedankenspiel, die Bindungen werden nicht tatsächlich gespalten.
Die Grafik rechts zeigt beispielhaft das Vorgehen beim Ermitteln der Oxidationszahlen der Atome des 5-Hydroxycytosin-Moleküls. Als Beispiel soll hier nun die Vorgehensweise am Kohlenstoff-Atom mit der Oxidationszahl ±0 erläutert werden: Dieses Kohlenstoffatom bildet drei Bindungen zu Nachbaratomen aus, zu Stickstoff, Wasserstoff und eine Doppelbindung zu einem anderen Kohlenstoffatom. Nun werden die Elektronegativitäten dieser Elemente verglichen; Kohlenstoff hat eine Elektronegativität von 2,55.
- Stickstoff hat eine Elektronegativität von 3,04. Da diese größer ist als die des Kohlenstoffs, bekäme der Stickstoff im Falle einer imaginären Spaltung der Bindung beide Bindungselektronen.
- Wasserstoff hat eine Elektronegativität von 2,2. Da diese kleiner ist als die des Kohlenstoffs, bekäme der Kohlenstoff im Falle einer imaginären Spaltung der Bindung beide Bindungselektronen.
- Das obere Kohlenstoffatom hat natürlich ebenfalls eine Elektronegativität von 2,55. Daher teilen sich die beiden Kohlenstoffatome im Falle einer imaginären Spaltung der Bindung die Bindungselektronen. Da es sich um eine Doppelbindung handelt, bekämen beide zwei.
Addiert bekommt das Kohlenstoffatom also vier Bindungselektronen. Elementarer Kohlenstoff besitzt ebenfalls vier Bindungselektronen, seine Ladung hat sich also durch die imaginäre Spaltung nicht geändert. Seine Oxidationszahl ist 0.
Im Vergleich dazu bekommt das unterste Stickstoffatom sechs Bindungselektronen im Falle einer imaginären Spaltung (je zwei von den beiden Kohlenstoffatomen und zwei von dem Wasserstoffatom). Elementarer Stickstoff besitzt nur drei Bindungselektronen. Da Elektronen negativ geladen sind, besäße das Stickstoffatom daher nach der imaginären Spaltung die Ladung -3. Dies ist daher auch seine Oxidationszahl.
Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt null ergeben, wenn das Gesamtmolekül ungeladen ist.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.10. 2020