
Salze
Als Salze bezeichnet man eine große Gruppe chemischer Verbindungen, die aus elektrisch positiv geladenen Kationen und negativ geladenen Anionen aufgebaut sind. Der Zusammenhalt der Salze in kondensierter Phase (Feststoff oder Flüssigkeit) beruht hauptsächlich auf der elektrostatischen Anziehung zwischen den gegensätzlich geladenen Ionen. Diese Anziehung heißt ionische Bindung. Im alltäglichen Sprachgebrauch versteht man unter Salz das Speisesalz (Natriumchlorid NaCl).
Eigenschaften
-
Viele Salze sind bei Raumtemperatur Feststoffe mit relativ hohen Schmelzpunkten. Als Feststoff kristallisieren Salze in charakteristischen Ionengittern, in denen die Ionen so angeordnet sind, dass die anziehenden und abstoßenden Coulomb-Kräfte zwischen ihnen im Mittel ausgeglichen sind und eine minimale potenzielle Energie resultiert. Sofern Salze sich bei den dafür nötigen, charakteristischerweise sehr hohen Temperaturen nicht zersetzen, können sie auch als Salzschmelzen in flüssiger Form vorliegen. Einen Sonderfall bilden ionische Flüssigkeiten, deren Schmelztemperatur unter 100 °C liegt.
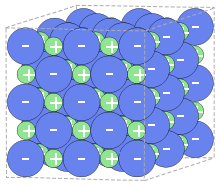 Kugelgitter: Struktur von Natriumchlorid; die Natriumionen sind grün, die Chloridionen blau dargestellt
Kugelgitter: Struktur von Natriumchlorid; die Natriumionen sind grün, die Chloridionen blau dargestellt
- Etliche Salze sind recht hart und spröde und haben glatte Bruchkanten bei mechanischer Bearbeitung. Diese Eigenschaften sind recht typisch für Feststoffe, die durch ein Ionengitter aufgebaut sind und daher Kristalle bilden. Aber nicht jeder kristalline Stoff ist ein Salz. So bildet Zucker (Saccharose) auch Kristalle, hat aber kein Ionengitter und zählt nicht zu den Salzen.
- Zahlreiche Salze sind löslich
in Wasser
und anderen polaren Lösungsmitteln.
Die Löslichkeit unterscheidet sich jedoch stark. Der in Wasser
gelöste Anteil von Salzen dissoziiert
bei der Lösung praktisch vollständig in hydratisierte
Ionen. Es handelt sich daher bei Salzen um starke
Elektrolyte, deren gelöste Ionen bewegliche Ladungsträger sind und
Salzlösungen eine hohe elektrische
Leitfähigkeit verleihen. Auch Salze, die in Wasser schwer löslich sind,
können als Salzschmelzen
elektrisch leiten, weil die Ionen in Schmelzen beweglich sind.
Bei wasserlöslichen Salzen überwindet das Wasser die Gitterenergie des
Ionengitters durch Hydratation.
Ist die Hydrationsenergie
ähnlich groß oder größer als die Gitterenergie, ist das Salz mäßig oder gut
löslich. In Lösungen sind die einzelnen Ionen von Wassermolekülen in mehreren
Hydratationssphären ummantelt.
Als Reaktion wird dies in der Chemie oft so dargestellt:
Das (s) weist auf einen Feststoff hin und (aq) markiert, dass das Ion hydratisiert vorliegt.
- Trockene Salzkristalle sind elektrische Isolatoren. Salzschmelzen und wässrige Lösungen leiten hingegen den elektrischen Strom aufgrund ihrer frei beweglichen Ionen als Ladungsträger; sie sind Elektrolyte.
- Das Lösen von Salzen in Wasser kann den pH-Wert der jeweiligen Lösung verändern. Beeinflusst das Salz den Wert nicht, spricht man von neutralen Salzen. Zu den neutralen Salzen zählt auch das Natriumchlorid. Andere Salze heben oder senken den pH-Wert. Man spricht von basischen oder sauren Salzen. Wie ein bestimmtes Salz reagiert, lässt sich nur schwer aus der Zusammensetzung der Verbindung abschätzen. Grundsätzlich gilt jedoch: Anionen (Säurereste) starker Säuren reagieren meist neutral. Säurereste von schwachen Säuren reagieren meist basisch. Beispielhaft für Salze, von denen mehrprotonige Säuren bekannt sind, ist das Verhalten der Phosphate. Das Lösen von Salzen in wässrigen Lösungen von organischen Molekülen, wie z.B. von Biomolekülen, kann zur Denaturierung der Biomoleküle führen oder auch die Ausfällung der Makromoleküle bewirken. Diese Wirkung von Salzen wird durch die sogenannte Hofmeister-Reihe charakterisiert.
Einteilung

Salze können nach verschiedenen Kriterien eingeteilt werden.
Eigenschaften
- Löslichkeit in Wasser
- Beeinflussung des pH-Wertes nach erfolgter Lösung in Wasser (basische, saure und neutrale Salze).
Struktur
Je nach Ionenradius und Ionenladung kristallisieren Salze in verschiedenen Gitterstrukturen. Diese lassen sich bei schön gewachsenen Kristallen auch makroskopisch beobachten.
Enthaltene Teilchen
- Anorganische Salze bestehen ausschließlich aus anorganischen Kationen und Anionen. Beispiele sind Natriumchlorid (NaCl) oder Calciumcarbonat (CaCO3). Die Kationen werden häufig von Metallen und die Anionen häufig von Nichtmetallen oder deren Oxiden gebildet.
- Die Halogenide enthalten einfach negativ geladene Ionen der Halogene (altgriechisch für "Salzbildner").
- Metallsalze enthalten Metalle als Kationen.
- Organische Salze sind aus Kationen und/oder Anionen aus dem Bereich der organischen Chemie aufgebaut. Im aus Methylamin und Essigsäure gebildeten Salz Methylammonium-Acetat sind beide Ionen organisch, im Methylammoniumchlorid nur das Kation und im Natriumacetat nur das Anion. Pharmazeutische (organische) Wirkstoffe werden oft als Hydrochloride verabreicht.
- Kristallwasserhaltige Salze enthalten neben den Ionen in bestimmten Mengen auch Wassermoleküle, das so genannte Kristallwasser. Es wird in der Verhältnisformel mit angegeben, wie hier im Beispiel von Natriumsulfat-Dekahydrat: Na2SO4·10 H2O.
- Doppelsalze sind Salze mit zwei verschiedenen Kationen oder Anionen, beispielsweise die Alaune mit der allgemeinen Zusammensetzung MIMIII(SO4)2. Beispiel: Aluminiumkaliumsulfat-Dodecahydrat (KAl(SO4)2 · 12 H2O).
Formelschreibweise
Als Formeln für Salze werden Verhältnisformeln verwendet. Sie geben an, in welchem Verhältnis die Ionen im Salz enthalten sind. Die Verhältnisformel eines Salzes wird durch die Ladungszahl der Ionen bestimmt, da sich positive und negative Ladungen kompensieren müssen. Verhältnisformeln von Salzen stehen damit im klaren Gegensatz zu Formeln von molekularen Verbindungen wie Wasser (H2O) oder Methan (CH4), welche die Anzahl Atome im einzelnen Molekül angeben.
Beispiele
- Natriumchlorid ist aus den Kationen Na+ und Anionen Cl− aufgebaut. Das Salz Calciumchlorid wird von Ca2+ und Cl− gebildet. Die Formeln NaCl und CaCl2 sind die Verhältnisformeln der Verbindungen (Na:Cl=1:1, bzw. Ca:Cl=1:2).
- Ammoniumcarbonat ist aus den Kationen NH4+ und Anionen CO32- aufgebaut. Die Ionen haben somit das Verhältnis NH4+ : CO32- = 2 : 1, die Verhältnisformel lautet (NH4+)2CO3.
Ionen
Ionen können ein- oder mehrwertig sein, also eine oder mehrere positive bzw. negative Ladungen tragen. Man unterscheidet einatomige und mehratomige Ionen. Letztere können sowohl geladene Moleküle (Molekülionen) als auch geladene Komplexe (Komplexionen) sein. In der folgenden Tabelle sind Beispiele einiger Ionen aufgeführt.
.png)
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Anorganische Salze
Anorganische Salze enthalten meist Metallatome als Kationen. Es existieren jedoch auch anorganische Molekül-Kationen, beispielsweise das Ammonium-Ion NH4+. Die einatomigen Anionen sind in der Regel Nichtmetall-Atome. Molekülionen entstehen vorwiegend bei Säure-Base-Reaktionen durch Aufnahme oder Abgabe eines Wasserstoff-Kations. Die anorganischen Komplexionen sind meist negativ geladen, also anionisch.
Aus anorganischen Ionen ist eine große Vielfalt an Salzen bekannt, unter anderem:
- Halogenide sind die Salze der Halogene (altgriechisch "Salzbildner"). Sie werden unterteilt in die Fluoride, Chloride, Bromide und Iodide. Alle Halogenid-Ionen sind einfach negativ geladen und die Halogenatome haben die Oxidationszahl −1. In der Natur sind vor allem Chloride häufig, gelöst im Meerwasser oder in großen Salzlagerstätten.
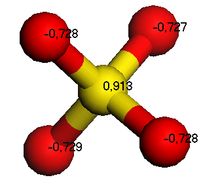
- Oxide bilden einen großen
Teil der Erdkruste. Das Sauerstoffatom im Oxidion hat die Oxidationszahl −2,
die Formel lautet O2−. Oxide treten jedoch nur im festen oder
geschmolzenen Zustand auf, in wässrigen Lösungen sind sie nicht bekannt. Ist
ein Oxid wasserlöslich, so reagiert es sofort in einer Hydrolyse, zum
Beispiel:
Natriumoxid reagiert mit Wasser unter Bildung von Hydroxid-Ionen zu Natronlauge.
Das nur schwer wasserlösliche Calciumoxid (CaO), auch gebrannter Kalk genannt, reagiert mit Wasser zu gelöschtem Kalk (Ca(OH)2). Sehr viele Oxide reagieren jedoch nicht mit Wasser, beispielsweise Eisen(III)-oxid (Fe2O3). - Sulfide sind ein häufiger Bestandteil von Mineralien in der Natur, z.B. Pyrit und Kupferglanz. Natriumsulfid (Na2S) ist ein lösliches Salz, die meisten Sulfide, wie Zinksulfid (ZnS) und Kupfer(II)-sulfid (CuS), sind in Wasser so gut wie unlöslich. In der analytischen Chemie wird die unterschiedliche (schlechte) Löslichkeit verschiedener Metallsulfide im Trennungsgang der Schwefelwasserstoffgruppe zur Trennung der Elemente verwendet.
- Carbonate leiten sich von der Kohlensäure H2CO3 ab und enthalten Carbonat-Ionen CO32−. Beispielsweise besteht Kalkstein hauptsächlich aus Calciumcarbonat.
- Sulfate heißen die Salze der Schwefelsäure H2SO4. Das Salz Calciumsulfat CaSO4 bildet den Hauptbestandteil von Gips.
- Phosphate leiten sich von der Phosphorsäure H3PO4 ab. Neben Natriumphosphat Na3PO4 gibt es auch die Salze Dinatriumhydrogenphosphat Na2HPO4 und Natriumdihydrogenphosphat NaH2PO4.
- Komplexsalze enthalten Komplexionen. Bei Kaliumhexacyanoferrat(II) (K4[Fe(CN)6]) bildet das Eisenion Fe2+ zusammen mit sechs Cyanid-Gruppen (CN−) gemeinsam ein stabiles Komplex-Anion mit vier negativen Ladungen. Im Salz liegen ionische Bindungen zwischen Kaliumionen und dem Hexacyanoferrat(II)-Anion vor. Analog bildet das Eisenion Fe3+ Kaliumhexacyanoferrat(III) (K3[Fe(CN)6]) ebenfalls ein Komplexsalz. Bei K3[Fe(CN)6] bildet das Eisenion Fe3+ zusammen mit sechs Cyanid-Gruppen (CN−) gemeinsam ein stabiles Anion mit drei negativen Ladungen. Bekannte Komplexsalze sind auch die Chromate ([CrO4]2−), zum Beispiel Kaliumchromat (K2[CrO4]), und die Permanganate ([MnO4]−), zum Beispiel im Kaliumpermanganat (K[MnO4]).
Organische Salze
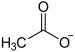
Neben den oben beschriebenen anorganischen Salzen gibt es auch zahlreiche Salze organischer Verbindungen. Die Anionen dieser Salze stammen von den organischen Säuren ab. Wichtig sind hier die Salze der Carbonsäuren, wie beispielsweise die Essigsäure, von der viele Salze, die so genannten Acetate (CH3COO−) bekannt sind. So kann sich mit Na+ das Salz Natriumacetat oder mit Cu2+ das Kupferacetat bilden. Essigsäure ist eine Monocarbonsäure (hat nur eine -COOH-Gruppe) und bildet nur einwertige Anionen. Zitronensäure ist eine Tricarbonsäure (hat drei -COOH-Gruppen) und kann dreiwertige Anionen bilden; ihre Salze nennt man Citrate. Bekannt sind beispielsweise die Salze Natriumcitrat und Calciumcitrat. Viele Acetate und Citrate bilden Kristalle, was aber nicht der eigentliche Grund ist, sie Salze zu nennen. Der wirkliche und einzige Grund liegt am Vorhandensein von ionischen Bindungen zwischen Anionen und Kationen. Innerhalb der Ionen von organischen Verbindungen liegen kovalente Bindungen vor.
Praktische Bedeutung haben die Salze der Carbonsäuren, die zu den Fettsäuren zählen. Die Natrium- oder Kaliumsalze der Fettsäuren nennt man Seifen. In Seifen liegen Stoffgemische verschiedener Fettsäuresalze vor. Praktische Verwendung finden sie als Kernseife bzw. Schmierseife. Als konkretes Beispiel bildet die Palmitinsäure Salze, welche Palmitate genannt werden. Salze, die auf so großen organischen Molekülen beruhen, sind in der Regel nicht kristallin.
Analog zu den anorganischen Sulfaten (SO42−) gibt es auch organische Sulfate (R-O-SO3−), wie Natriumlaurylsulfat, welche als Tenside in Shampoos und Duschgelen Verwendung finden. Auch von Alkoholen sind Salze, die Alkoholate, bekannt. Alkohole sind äußerst schwache Säuren und werden daher fast nie so genannt. Unter aggressiven Reaktionsbedingungen lassen sich Verbindungen der Form R-O−M+ (M = Metall) gewinnen. In Analogie zu vielen anorganischen Oxiden (MO) reagieren Alkoholate bei Kontakt mit Wasser unter Hydrolyse und es bilden sich die entsprechenden Alkohole.
C,H-acide Verbindungen bilden mit ausreichend starken Basen auch Salze. Diese sind bei Reaktionen wie der Knoevenagel-Kondensation und der Aldolreaktion wichtige Zwischenstufen.
| Hydrolyse oxidischer Salze | |
|---|---|
| Natriumethanolat | |
| Natriumoxid | |
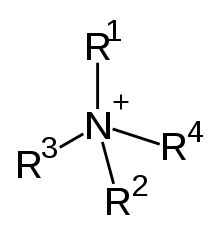
Unter den organischen Kationen haben die zum Ammonium-Kation (NH4+) analogen Verbindungen Bedeutung. Man nennt sie allgemein quartäre Ammoniumverbindungen. Bei diesen Verbindungen trägt das Stickstoffatom in der Regel vier Alkylgruppen (R-) und eine positive Ladung. Die Alkylammoniumverbindung Cetyltrimethylammoniumbromid zum Beispiel ist eine organische Ammoniumverbindung, bei der ein Bromatom als Anion vorliegt. Praktische Bedeutung haben Ammoniumverbindungen mit drei kurzen und einer langen Alkylgruppe, da diese Kationen in wässriger Lösung die Eigenschaft von Tensiden zeigen. Verbindungen dieser Art spielen auch eine wichtige Rolle im Stoffwechsel von Lebewesen, wie etwa das Cholin.
Prinzipiell kann jedes organische Amin durch Aufnahme eines Protons (H+) zu einem Kation werden. Analog zu der Reaktion von Ammoniak (NH3) zum Ammonium-Ion (NH4+) reagiert beispielsweise ein primäres Amin (R-NH2; R = organischer Rest) zum Kation R-NH3+. Da solche Verbindungen meist polarer und daher leichter wasserlöslich sind als die ursprünglichen Stoffe, werden zum Beispiel stickstoffhaltige Arzneistoffe (Pharmawirkstoffe) durch Versetzen mit Salzsäure zu Salzen, den so genannten Hydrochloriden überführt. Dies erleichtert ihre Aufnahme in den Körper. Hydrochloride lassen sich im Gegensatz zu den Aminen leichter durch Umkristallisation reinigen. Analog bilden Amine mit Bromwasserstoff Hydrobromide und mit Fluorwasserstoff Hydrofluoride.
Neben Molekülen, die eine positive oder negative Ladung tragen, existieren auch Moleküle, die über eine negative und positive Ladung verfügen. Man nennt sie Innere Salze oder auch Zwitterionen. Die Stoffgruppe der Betaine zählt zu den inneren Salzen, deren einfachste Verbindung das Betain ist.
Die Aminosäuren verfügen über eine Carboxy-Gruppe (-COOH) und eine Amino-Gruppe (-NH2) und können so sauer und basisch reagieren. In einer inneren Neutralisation bilden sich eine anionische (-COO−) und eine kationische (-NH3+) Gruppe und damit ein Zwitterion. Die einfachste Aminosäure ist das gut in Wasser lösliche Glycin. Zwitterionen zeigen im Gegensatz zu anderen in Wasser gelösten Ionen eine schlechte (keine) elektrische Leitfähigkeit. (Ampholyte)
Beispiele organischer Kationen und Anionen
| Anionen organischer Verbindungen | ||
|---|---|---|
| Stoffgruppe | Beispiel | Struktur |
| Carbonsäuresalze | Acetate |
 |
| Palmitate |
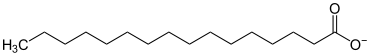 | |
| Citrate |
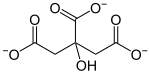 | |
| organische Sulfate | Laurylsulfate |
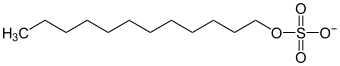 |
| Alkoholate | Ethanolate |
|
| Kationen organischer Verbindungen | ||
| Stoffgruppe | Beispiel | Struktur |
| quartäre Ammonium- verbindungen |
Cetyltrimethylammonium |
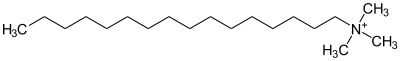 |
| Cholin |
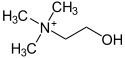 | |
| organische Ammonium- Verbindungen |
Salze des Anilins, z.B. Anilin-Hydrochlorid |
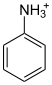 |
| Innere Salze: Kation und Anion in einem Molekül | ||
| Stoffgruppe | Beispiel | Struktur |
| Betaine | Betain |
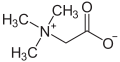 |
| Aminosäuren | Alanin |
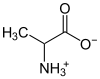 |
Herstellung von anorganischen Salzen
Reaktionen von Säuren und Basen
Salze entstehen bei der Reaktion von Säuren mit Basen (griechisch basis; Arrhenius: Basen sind die Basis für Salze). Dabei bildet das Oxonium-Ion der Säure mit dem Hydroxid-Ion der Base Wasser (Neutralisation). Einige Salze sind schwer löslich in Wasser und bilden direkt den Feststoff. In der Regel liegt das Salz in Lösung vor und kann durch Verdampfen des Wassers als Feststoff gewonnen werden.
| Säure + Base → Salz + Wasser |
|---|
Salzsäure + Natronlauge → Natriumchlorid + Wasser |
Schwefelsäure + Bariumhydroxid → Bariumsulfat + Wasser |
Aus anderen Salzen
Einige Salze lassen sich aus zwei anderen Salzen gewinnen. Mischt man wässrige Lösungen von zwei Salzen, kann sich ein drittes Salz als Feststoff bilden. Dies gelingt nur, wenn das dritte Salz im Gegensatz zu den anderen beiden schlechter löslich ist.
| Salzlösung A + Salzlösung B → Salz C + Salzlösung D |
|---|
Natriumchlorid + Silbernitrat → Silberchlorid + Natriumnitrat |
Calciumchlorid + Natriumcarbonat → Calciumcarbonat + Natriumchlorid |
Reaktion von Oxiden
Wie oben beschrieben tendieren viele Metalloxide dazu, mit Wasser Hydroxide zu bilden. Unter sauren Bedingungen reagieren auch Metalloxide, die in reinem Wasser „unlöslich“ (= stabil) sind. Auf diesem Weg lassen sich viele Salze, wie etwa Kupfersulfat gewinnen.
| Metalloxid + Säure → Salz + Wasser |
|---|
Kupfer(II)-oxid + Schwefelsäure → Kupfersulfat + Wasser |
Andere Reaktionen
Die Ionen in den oben beschriebenen Reaktionen werden nicht erst gebildet, sondern sie existieren bereits vor der Bildung eines neuen Salzes. Sind bei Reaktionen zur Bildung eines neuen Salzes keine oder nicht alle Ionen mit der nötigen Ladung vorhanden, finden Redoxreaktionen statt. So lassen sich aus elementaren Metallen und Nichtmetallen Salze gewinnen. Reaktionen dieser Art werden unter Salzbildungsreaktion näher beschrieben.
Grenzen des Begriffs Salze
- Stoffe sind nur Salze, wenn ionische Bindungen zwischen den Teilchen der Verbindung vorliegen. Ob dieser Bindungstyp vorliegt, lässt sich jedoch nicht leicht ableiten. Während bei Calciumoxid (CaO) ionische Bindungen wirken, liegen bei Chrom(VI)-oxid (CrO3) nur kovalente Bindungen zwischen Chrom- und Sauerstoffatomen vor; es ist somit kein Salz. Daher ist es besser, in diesen Fällen statt von Salzen von Metalloxiden zu sprechen.
- Salze werden historisch bedingt in der Regel als chemische Verbindungen aufgefasst, da sie eine definierte Zusammensetzung aus verschiedenen chemischen Elementen haben. Es sind jedoch Mischkristalle aus zwei Salzen bekannt, die nicht stöchiometrisch zusammengesetzt sind: So bildet Kaliumpermanganat (K[MnO4]) mit Bariumsulfat (Ba[SO4]) in fast beliebigen Mengenverhältnissen Mischkristalle (wenn auch nur bis zu einem bestimmten Maximum an Bariumsulfat), da die Komponenten ähnliche Kristallstrukturen und Gitterabstände aufweisen. Eine chemische Ähnlichkeit der beteiligten Verbindungen oder eine gleiche Wertigkeit ist für die Bildung von Mischkristallen nicht nötig.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.10. 2025