
Amine
Als Amine werden organische Verbindungen bezeichnet, die letztlich Abkömmlinge des Ammoniaks (NH3) sind und bei denen ein, zwei oder alle drei Wasserstoffatome des Ammoniaks durch Alkylgruppen oder Arylgruppen ersetzt sind oder sich zu mehr oder weniger unterschiedlichen heterocyclischen Ringsystemen zusammengeschlossen haben. Da Amine noch dazu auch mehr als ein N-Atom enthalten können, ist die Anzahl von möglichen Aminen so groß und ihre Strukturen sind so unterschiedlich, dass man Strukturen und Eigenschaften nicht in einem einzigen Artikel darstellen kann. Auf cyclische Amine wird nur am Rande eingegangen; deshalb sei verwiesen auf den Artikel Heterocyclen.
Systematik nicht-cyclischer Amine
Generell kann man drei große Typen von nicht-cyclischen Aminen unterscheiden. Entsprechend der Anzahl der Wasserstoff-Atome, die im Ammoniak gegen organische Alkyl- oder Arylgruppen ausgetauscht wurden, spricht man von primären, sekundären und tertiären Aminen. Diese drei Typen können zusätzlich je nach Art der an das N-Atom gebundenen Gruppen noch genauer als aliphatische, aromatische, oder auch als gemischt aliphatisch-aromatische Amine bezeichnet werden. Wenn das an das N-Atom gebundene C-Atom Teil einer C-C-Doppelbindung ist, wie z.B. im Ethenamin, werden die Verhältnisse kompliziert, denn solche Verbindungen bilden tautomere Formen.
Amine können auch zwei an verschiedene C-Atome gebundene N-Atome (Aminogruppen) enthalten; dann spricht man von Diaminen, die auch verschiedenen Typs sein können. Wenn – wie bei einem aliphatischen, sekundären Amin – zwei an ein N-Atom gebundene Alkylgruppen vorhanden sind, können beide Alkylgruppen auch zu einem Ring geschlossen sein. Dann spricht man von cyclischen sekundären Aminen, wie z.B. beim Piperidin. Auch bei den Diaminen kann der Ringschluss erfolgen, wie z.B. beim Piperazin. Solche cyclischen Amine ohne C-C-Doppelbindungen im Ringsystem gehören zwar zu der sehr großen und sehr variablen Gruppe der heterocyclischen Amine, verhalten sich aber wie normale, nicht cyclische Amine.
Alle Amine können durch Alkylierung in quartäre Ammoniumverbindungen umgesetzt werden. Quartäre Ammoniumverbindungen sind also keine Amine, sondern gehören zu einer weiteren, eigenen Verbindungsklasse, die sich von den jeweiligen Aminen ableiten. Die in der Tabelle am Ende gezeigte quartäre Ammoniumverbindung ist also kein Amin, sondern ein quartäres Ammoniumsalz des einfachsten Typs.
| Amine und Ammoniumsalze | |||||
|---|---|---|---|---|---|
| Typen | Funktionelle Gruppe | Beispiel | |||
| primäre Amine | R–NH2 | primäre Aminogruppe | R–NH2 | Methylamin | 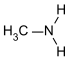 |
| sekundäre Amine | RNH–R | sekundäre Aminogruppe | R–NH-R | Dimethylamin | 2-nh.png) |
| tertiäre Amine | NR3 | tertiäre Aminogruppe | R–NR2 | Trimethylamin | 3-n.png) |
| keine Amine, sondern quartäre Ammoniumverbindungen |
NR4+ (X−) | quartäre Ammoniumgruppe | R–NR3+ | Tetramethyl- ammoniumchlorid |
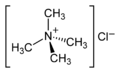 |
Eigenschaften
Chemische Eigenschaften
Aliphatische Amine
Wie Ammoniak sind alle aliphatischen Amine mehr oder weniger starke Basen, weil ein Proton
an das freie
Elektronenpaar des N-Atoms angelagert werden kann. Ein Maß für die
Basenstärke des Amins ist die Basenkonstante
des Amins bzw. die Säurekonstante
des zugehörigen Ammoniumkations, ausgedrückt durch den -Wert
der Base, bzw. durch den
-Wert
des Ammoniumkations. Diese Werte geben Auskunft über die Lage des folgenden
Gleichgewichts für die Protonierung
eines primären Amins durch Wasser
und damit Auskunft über die Basenstärke des Amins bzw. über die Säurestärke des
zugehörigen Ammoniumkations:
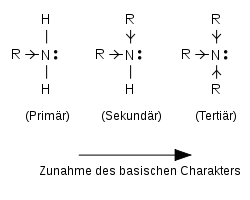
Da die durch die Protonierung entstehenden Ammoniumkationen meist besser in Wasser löslich sind als die ursprünglichen Amine, ist die Extraktion mit wässriger Salzsäure die einfachste Methode zur Abtrennung der Amine von anderen nicht basischen organischen Substanzen. Die Art der Substitution und der Substitutionsgrad kann die Basizität von Aminen stark beeinflussen. Bei aliphatischen Aminen erhöhen Alkylgruppen als Substituenten wegen ihres „elektronenschiebenden“ Effektes (Induktiver Effekt, +I-Effekt) die Elektronendichte am Stickstoffatom. Man kann also erwarten, dass das freie Elektronenpaar am N-Atom zunehmend leichter protoniert wird, wenn die Anzahl von Alkylgruppen am N-Atom (Substitutionsgrad) steigt. Das trifft jedoch nur dann zu, wenn keine weiteren störenden Effekte – wie z.B. die Hydratisierung der Amine und der gebildeten Ammoniumkationen durch Wassermoleküle – wirksam werden. Wenn keine Störungen vorliegen, dann spricht man von der sog. Gasphasen-Acidität. Unter solchen wasserfreien Bedingungen nimmt bei aliphatischen Aminen die Basizität wie erwartet mit zunehmender Substitution zu. Damit sind aliphatische Amine auch stärkere Basen als Ammoniak in der Reihenfolge:
Ammoniak < primär < sekundär < tertiär.
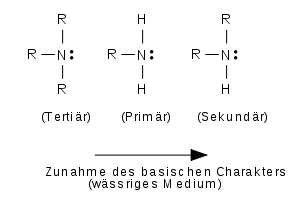
In Gegenwart von Wasser wird bei der Hydratisierung von Ammoniak und der Amine und Ammoniumkationen Hydratationswärme frei, bei primären Aminen am meisten und bei tertiären Aminen am wenigsten. Mit zunehmendem Substitutionsgrad wird offenbar die Hydratisierung sterisch behindert. Diese Effekte führen zu einer veränderten Reihenfolge der Basizität in wässrigen Lösungen:
In wässeriger Lösung zeigen aliphatische Amine folgende Reihenfolge der Basizität:
tertiär < primär < sekundär.
Die geschilderten Abstufungen und die deutlich geringere Basizität tertiärer
Amine in wässerigen Lösungen spiegelt sich auch in den
und
-Werten von Ammoniak und der drei einfachsten Alkylamine
wieder.
- Ammoniak:
9,25;
= 4,75;
- Methylamin:
10,6;
= 3,4; (alle prim. aliph. Amine haben ähnliche Werte).
- Dimethylamin:
10,8;
= 3,2;
- Trimethylamin:
9,8;
= 4,2;
Aromatische Amine
Während die Basizität aliphatischer Amine wegen des +I-Effekts der
Alkylgruppen größer ist als die von Ammoniak, ist die Basizität aromatischer Amine
deutlich geringer als die Basizität von Ammoniak. Deshalb ist der -Wert
des einfachsten aromatischen Amins Anilin
mit 9,37 deutlich größer als der von Ammoniak mit 4,75. Durch die
Delokalisierung des freien Elektronenpaars am Stickstoffatom in das aromatische
System des Phenylrings wird die deprotonierte Form stabilisiert und aromatische
Amine sind deutlich schwächer basisch als Ammoniak oder aliphatische Amine
(formal ein −M-Effekt). Weitere elektronenabziehende Substituenten am
aromatischen Ringsystem des Anilins – wie z.B. die Nitrogruppe in Nitroanilinen können die
Basizität noch weiter drastisch verringern.
Heterocyclische Amine
Die Eigenschaften cyclischer Amine sind je nach Art der Ringsysteme, die aus mehreren unterschiedlich verknüpften Ringsystemen verschiedenster Art bestehen können, sehr unterschiedlich und können nicht allgemein beschrieben werden. So verhalten sich z.B. cyclische Amine mit nichtaromatischen Ringsystemen ohne Doppelbindungen, wie z.B. Piperidin, wie normale sekundäre, aliphatische Amine. Dagegen verhält sich das cyclische Amin mit einem Ringsystem und drei konjugierten Doppelbindungen, das Pyridin, nicht wie ein normales tertiäres aliphatisches Amin. Amine dieser Art sind auch Basen, haben aber sehr unterschiedliche Eigenschaften und bilden eine eigene, neue Verbindungsklasse: aromatische, heterocyclische Amine.
Physikalische und physiologische Eigenschaften
Aliphatische Amine wie Monomethylamin, Dimethylamin und Trimethylamin sowie Ethylamin sind bei Raumtemperatur gasförmig. Viele weitere homologe Verbindungen sind flüssig und einige noch höhere homologe Amine, wie z.B. Decylamin sind bei Raumtemperatur fest.
Das einfachste aromatische Amin Anilin ist flüssig. Viele substituierte Aniline und andere aromatische Amine mit mehreren aromatischen Ringsystemen, wie z.B. Naphthylamine sind fest.
Infolge ihrer Polarität und Basizität sind Amine besser in Wasser löslich als Kohlenwasserstoffe mit gleicher Anzahl von C-Atomen. Mit steigender Länge der Alkylketten nimmt die Wasserlöslichkeit aliphatischer Amine ab. Aromatische Amine sind nicht in Wasser löslich. Flüssige primäre und sekundäre aliphatische und aromatische Amine sind über Wasserstoffbrückenbindungen assoziiert. Dies führt – ähnlich wie bei Alkoholen – zu höheren Siedepunkten im Vergleich zu analogen Kohlenwasserstoffen.
Gasförmige aliphatische Amine reizen die Schleimhäute der Augen und der Atemwege. Bei der Benetzung der Haut mit flüssigen Alkylaminen kommt es ebenfalls zu Verätzungen. Vergiftungen durch Einatmen höherer Konzentrationen können Blutdrucksteigerung und kurzdauernde Krämpfe bewirken. Aromatische Amine sind wegen ihrer geringeren Basizität und geringeren Flüchtigkeit zwar nicht reizend, sind aber im Vergleich zu aliphatischen Aminen deutlich giftiger, wie z.B. Anilin.
Gasförmige aliphatischen Amine besitzen einen dem Ammoniak ähnlichen, aber zusätzlich „fischigen, fauligen“ Geruch. Höhere Homologe und aromatische oder heterocyclische Amine besitzen ebenfalls von Menschen als unangenehm empfundene Gerüche, etwa nach Fäkalien (Indol, Skatol), oder nach verwesendem Fleisch (Cadaverin, Putrescin), nach Urin oder altem Fisch (Methyl-, Ethyl- und Trimethylamin). Solche Verbindungen können als Zwischen- oder Endprodukte beim anaeroben Abbau von biologischem Material, insbesondere von Proteinen, oder durch Decarboxylierung von Aminosäuren entstehen. Für den charakteristischen Geruch von Sperma ist Spermin – ein lineares Polyamin – mit zwei primären und zwei sekundären Aminogruppen, verantwortlich.
Andererseits gehören aber auch viele Arzneimittel zur Gruppe der Amine, besonders häufig zur Untergruppe der heterocyclischen Amine, wie z.B. Atropin Amphetamin, Chinin, Codein und Coffein aber auch Drogen, wie z.B. Methamphetamin, Kokain, Nicotin.
Herstellung, Entstehung
Die Vorstellung, dass Amine durch Alkylierung von Ammoniak z.B. mit Alkylhalogeniden einfach darstellbar sind, ist eine Fehleinschätzung, nicht nur weil Ammoniak gasförmig ist. Bei der Alkylierung von Ammoniak würden Gemische aller Alkylierungsstufen entstehen, da die zunächst gebildeten primären Amine sogar bevorzugt weiter alkyliert werden zu sekundären Aminen, diese zu tertiären Aminen und diese zuletzt zu quartären Ammoniumsalzen.
Primäre Amine
Zur gezielten Darstellung von primären Aminen gibt es folgende wichtige Methoden:
- Häufig wird die Gabriel-Synthese benutzt. Bei dieser Reaktion wird zunächst Phthalimid mit dem entsprechenden Alkylhalogenid umgesetzt und das entstandene Alkyl-Phthalimid anschließend mit Natronlauge durch Hydrolyse oder besser mit Hydrazin durch Hydrazinolyse aufgearbeitet, um das primäre Amin freizusetzen.
- Als Alternative können Alkylhalogenide mit Natriumazid zu Alkylaziden umgesetzt werden, die dann anschließend mit Lithiumaluminiumhydrid zu primären Aminen reduziert werden.
- Unter Kettenverlängerung erfolgt die Umsetzung eines Alkylhalogenids mit Natriumcyanid zum Nitril, das anschließend zum primären Amin reduziert wird.
- Beim Carbonsäureamid-Abbau nach Hofmann entstehen ebenfalls primäre Amine, wobei aber die Kohlenstoffkette um ein Kohlenstoffatom verkürzt wird.
- Eine weitere Möglichkeit der Synthese für primäre Amine unter Kettenverkürzung ist die Curtius-Reaktion, bei der das Amin über den Abbau eines Acylhydrazids hergestellt wird.
Sekundäre Amine
- Sekundäre Amine lassen sich aus primären Aminen darstellen, indem das primäre Amin R'-NH2 mit einem Aldehyd R-CH=O zum Imin (R-CH=N-R') umgesetzt wird, das anschließend durch Hydrierung der Doppelbindung zum sekundären Amin reduziert wird.
Tertiäre Amine
Zur Herstellung von tertiären Aminen eignet sich die Leuckart-Wallach-Reaktion.
Aromatische Amine
Aromatische Amine werden durch Nitrierung und anschließende Reduktion hergestellt (z.B. Anilin, Toluidin).
Technische Verfahren
- Technische Verfahren zur Herstellung von Aminen sind Umsetzungen von Ammoniak mit Alkoholen, bei denen z.B. Alkylamine wie Methyl- und Ethylamin entstehen, die dann getrennt werden müssen. Auch Aldehyde bzw. Ketone können mit Ammoniak umgesetzt werden, wobei z.B. Isopropylamine entstehen. Durch weitere Alkylierungen mit Chloralkanen entstehen insbesondere Feinchemikalien und quartäre Ammoniumsalze.
- Die Reduktion von Nitrilen liefert z.B. Fettamine
- Im großtechnischen Maßstab wird die Umsetzung von Epoxiden mit Aminen bzw. Ammoniak durchgeführt. Dabei entstehen Ethanolamine, Isopropanolamine etc.
- Die Nitrierung von Alkanen und anschließende Reduktion zum Alkylamin sowie die Hydroaminierung von Olefinen hat technisch nur eine geringe Bedeutung. Sie werden jedoch beide ebenfalls im technischen Maßstab betrieben.
Biologische Prozesse
- Bei biologischen Vorgängen können Amine bei Abbau- und Verwesungsprozessen durch Decarboxylierung von Aminosäuren entstehen.
Die im Eiweiß (z.B. von Fischen) peptidisch gebundenen Aminosäuren werden nach dem Tod der Tiere biochemisch zu Aminen und Kohlendioxid abgebaut. Amine sind für den charakteristischen Geruch von Fischen verantwortlich, der bisweilen als unangenehm empfunden wird. Fisch wird oft mit einem Stückchen Zitrone serviert. Wie alle Säuren protoniert auch Citronensäure Amine unter Bildung von Citraten (Salze der Citronensäure) und kann so den Amingeruch vermindern.
Vorkommen
- Amine kommen in Pflanzen, Tieren und im Menschen natürlich vor und werden dann als biogene Amine bezeichnet, die aus Aminosäuren durch Decarboxylierung entstehen können. Biogene Amine haben eine große Bedeutung als Gewebshormone, wie z.B. Histamin und Serotonin, die aus den Aminosäuren Histidin bzw. Tryptophan entstehen. Diese beiden Aminosäuren gehören zu den basischen Aminosäuren, die neben der obligatorischen α-ständigen Aminogruppe durch zusätzliche Aminogruppen gekennzeichnet sind. Im Histidin ist der Ring des heterocyclischen Amins Imidazol die zusätzliche basische Gruppe, im Tryptophan ist das heterocyclische Amin Indol die zusätzliche basische Gruppe.
- Als Neurotransmitter-Substanzen kann man die Katecholamine bezeichnen, zu denen die primären aliphatischen Amine Dopamin und Noradrenalin gehören. Beide Verbindungen enthalten jeweils auch noch ein zusätzliches aromatisches Ringsystem. Das Adrenalin ist dem Noradrenalin sehr ähnlich, ist aber zusätzlich am N-Atom methyliert und ist damit ein sekundäres aliphatisches Amin.
- Weiterhin findet man heterocyclische Amine wie Purin und Pyrimidin als sogenannte Nucleinbasen in den strukturellen Grundbausteinen der Nucleoside in der DNA.
- Aminosäuren, die Bausteine von Peptiden, sind keine Amine und auch keine Carbonsäuren. Sie enthalten zwar die funktionellen Gruppen der beiden Verbindungsklassen, zeigen aber nicht deren typischen Eigenschaften.
Chemische Reaktionen
Amine reagieren mit Salpetriger Säure je nach Art des eingesetzten Amins zu unterschiedlichen Produkten.
- Primäre aliphatische und aromatische Amine reagieren zu Diazoniumsalzen, die als Ausgangsprodukte für weitere Synthesen vielfältig genutzt werden können.
- Sekundäre Amine reagieren mit sogenannten nitrosierenden Agentien (Salpetrige Säure, Stickstoffoxide, Nitrite) vor allem im sauren Milieu, wie es etwa im menschlichen Magen herrscht, zu Nitrosaminen. Da sekundäre Amine in Nahrungsmitteln vorkommen und Nitrosamine cancerogene Wirkung haben, verdient diese Reaktion Beachtung.
Auch tertiäre aliphatische Amine können unter Abspaltung einer Alkylgruppe langsam zu Nitrosaminen reagieren; aromatische tertiäre Amine reagieren mit den elektrophilen nitrosierenden Agentien am aromatischen Ringsystem, und es entstehen aromatische Nitrosoverbindungen.
- Als elektronenreiche Verbindungen sind aromatische Amine reaktive Reaktionspartner für elektrophile aromatische Substitutionen.
- Amine sind Reaktanten bei zahlreichen nukleophilen Substitutionsreaktionen beispielsweise bei der Bildung von Carbonsäureamiden, Carbonsäureimiden oder Lactamen und Iminen. Deswegen können Amine als Schutzgruppen von Carbonylverbindungen eingesetzt werden oder als chirale Auxiliare.
- Bei Eliminierungen werden voluminöse sekundäre oder tertiäre Amine als Protonenakzeptoren genutzt, die zwar basisch, aber nicht nucleophil sind.
- Weiterhin finden Amine, meist Diamine oder Triamine, Anwendung als Liganden in der Komplexchemie.
Verwendung
- Aromatische Amine werden zur Herstellung von Azofarbstoffen verwendet.
- Amine sind Bausteine für Agro- und Pharmachemikalien sowie für Tenside, Beschichtungen und Schmierstoffe.
- Im Bereich der Gießereitechnik finden Amine als Katalysatoren Anwendung, um den Aushärtvorgang der Bindemittel im Formsand bei der Kernherstellung nach dem Cold-Box-Verfahren zu beschleunigen.
- Als Katalysatoren dienen Amine und Diamine auch zur Herstellung und zur Vernetzung von Polyurethanen. Ihre puffernde Wirkung wird genutzt, wenn sie in wässrigen Systemen als Korrosionsinhibitoren eingesetzt werden.
- Ein weiteres wichtiges Anwendungsfeld für Amine ist die Gaswäsche in Raffinerien und Kraftwerken.
Nachweis von Aminen
- Zum Nachweis von Stickstoff in einer organischen Verbindung kann ein Natrium-Aufschluss der zu untersuchenden Substanz durchgeführt werden. In der neutralisierten Aufschluss-Lösung kann Stickstoff als Cyanid mit der Lassaigne-Probe als Berliner Blau nachgewiesen werden, oder, falls die Substanz gleichzeitig Schwefel enthielt, als Thiocyanat mit Eisen(III)-chlorid. Diese Nachweise sind allerdings nicht spezifisch für Amine, sondern zeigen nur an, dass die Analysensubstanz Stickstoff enthielt.
- Amine sind oft schon durch ihren charakteristischen stechenden oder unangenehmen Geruch (ammoniakartig bis fischig) erkennbar. Das reicht aber für einen Nachweis nicht aus.
- Um den Substitutionsgrad des Amins zu bestimmen, also ob ein primäres, sekundäres oder tertiäres Amin vorliegt, wird die Hinsberg-Trennung durchgeführt. Hierbei wird das Amin zum p-Toluolsulfonsäureamid umgesetzt:
Tertiäre Amine und quartäre Ammoniumsalze bilden keine Sulfonamide,
Sekundäre Amine bilden Sulfonamide, die nicht in Alkali löslich sind,
Primäre
Amine bilden Sulfonamide, die in Alkali löslich sind.
- Die eindeutige Identifizierung eines unbekannten Amins erfolgt entweder massenspektrometrisch oder über ein geeignetes Derivat, dessen charakteristischer Schmelzpunkt bestimmt wird:
- Primäre und sekundäre Amine: Als Derivat eignet sich das aus der Hinsberg-Trennung bereits gewonnene Sulfonamid (siehe oben).
- Tertiäre Amine: Hier ist die Fällung des Pikrates zu empfehlen.
Primäre, sekundäre und tertiäre Amine können mittels HPLC chromatographisch ohne Derivatisierung getrennt werden. Die Detektion und Quantifizierung erfolgt mit einem massenselektiven Detektor (HPLC/MS). Zur eindeutigen Bestimmung von Aminen gleicher molarer Masse (z.B. Diethylamin und Butylamin) empfiehlt sich der Einsatz von Standardsubstanzen zur Kalibrierung.
Siehe auch
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 22. Auflage. 1991, ISBN 3-7776-0485-2.
- Autorengemeinschaft: Organikum. 22. Auflage. Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 12.11. 2025