Nukleoside
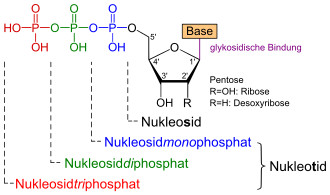
Nukleoside (auch Nucleoside) sind organische Moleküle, die aus einer Nukleobase und einer Pentose bestehen. In einer Zelle kommen verschiedene Nukleoside vor, die sich im Basen- oder Zuckeranteil unterscheiden. Sie enthalten im Gegensatz zu den Nukleotiden, welche die Nukleinsäuren (DNA oder RNA) aufbauen, keine Phosphatreste.
Grundtypen
Die fünf Grundtypen der Nukleoside bestehen entweder aus einer Purin- oder einer Pyrimidinbase. Wenn sie Bausteine einer RNA sind, ist die Pentose (ein Einfachzucker mit fünf C-Atomen) die Ribose, in der DNA liegt als Pentose die Desoxyribose vor. Deshalb nennt man die Bausteine der DNA genauer Desoxynukleoside, während Nukleoside im engeren Sinne die Bausteine der verschiedenen RNA-Formen sind. Die Verknüpfung von Base und Pentose erfolgt bei den Purin-Basen stets über das Stickstoffatom in Position 9, bei den Pyrimidin-Basen über das Stickstoffatom in Position 1 und das C1′-Atom des Zuckers.
Purin-Basen
| Nukleobase | Nukleosid | Desoxynukleosid |
|---|---|---|
 |
 |
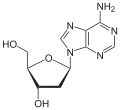 |
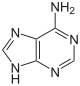
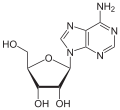
| Adenin | Adenosin, A | Desoxyadenosin, dA |
 |
 |
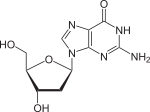 |
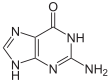
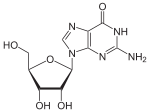
| Guanin | Guanosin, G | Desoxyguanosin, dG |
Anmerkung: Es ist jeweils nur eine der möglichen tautomeren Strukturen dargestellt.
Pyrimidin-Basen
| Nukleobase | Nukleosid | Desoxynukleosid |
|---|---|---|
 |
 |
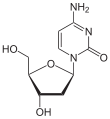 |
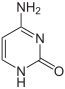
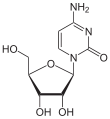
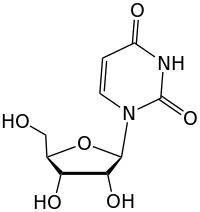
| Cytosin | Cytidin, C | Desoxycytidin, dC |
 |
 |
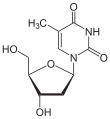 |
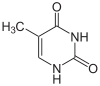
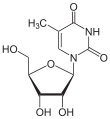
| Thymin | Ribothymidin T (= 5-Methyluridin) | Desoxythymidin, dT |
 |
 |
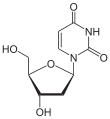 |
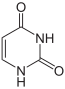
| Uracil | Uridin, U | Desoxyuridin, dU |
Abwandlungen der Grundformen
Neben diesen Grundformen gibt es noch zahlreiche Modifikationen, die vor allem in den tRNAs und rRNAs zu finden sind. Einige finden sich auch in der DNA. Diese veränderten Nukleoside entstehen in der Regel erst nach der Transkription und dienen einer Feineinstellung von Struktur, Aktivität und Spezifität der Moleküle. Die meisten Modifikationen entstehen durch Methylierung.
Einen Überblick über die möglichen Abwandlungen soll die folgende Auswahl geben. Zum Vergleich sind die Grundformen ebenfalls angeführt:
Pyrimidin-Nukleoside
| Name | Symbol | Pyrimidin-Grundstruktur | R1 | R2 | R3 | R4 | R5 | R6 |
|---|---|---|---|---|---|---|---|---|
| Cytidin | C | 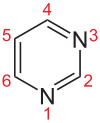 |
Ribose | =O | –NH2 | |||
| 3-Methylcytidin | m3C | Ribose | =O | –CH3 | –NH2 | |||
| 5-Methylcytidin | m5C | Ribose / Desoxyribose | =O | –NH2 | –CH3 | |||
| N4-Methylcytidin | m4C | Ribose / Desoxyribose | =O | –NH–CH3 | ||||
| N4,N4-Dimethylcytidin | m42C | Ribose | =O | –N(CH3)2 | ||||
| 2′-O-Methylcytidin | Cm | 2′-O-Methyl-ribose | =O | –NH2 | ||||
| Isocytidin (synth.) | iC | Ribose | –NH2 | =O | ||||
| Pseudocytidin (synth.) | ΨC | –H | =O | –NH2 | Ribose | |||
| Pseudoisocytidin (synth.) | psiC | –H | –NH2 | =O | Ribose | |||
| 2-Thiocytidin | s2C | Ribose | =S | –NH2 | ||||
| N4-Acetylcytidin | ac4C | Ribose | =O | –NH–CO–CH3 | ||||
| Uridin | U | Ribose | =O | =O | ||||
| 3-Methyluridin | m3U | Ribose | =O | –CH3 | =O | |||
| 2′-O-Methyluridin | Um | 2′-O-Methyl-ribose | =O | =O | ||||
| Pseudouridin | P, Ψ, Ψrd | –H | =O | =O | Ribose | |||
| Dihydrouridin | D, UH2, Uh | Ribose | =O | =O | –H,–H | –H,–H | ||
| 5-Methoxyuridin | mo5U | Ribose | =O | =O | –O–CH3 | |||
| 5-(Carboxyhydroxymethyl)-Uridin | chm5U | Ribose | =O | =O | –CH(OH)–CO2CH3 | |||
| 5-Carboxymethylaminomethyl-Uridin | cmnm5U | Ribose | =O | =O | –CH2–NH–CH2–CO2CH3 | |||
| 5-Methylaminomethyl-Uridin | mnm5U | Ribose | =O | =O | –CH2–NH–CH3 | |||
| 5-Methoxy-carbonylmethyl-Uridin | mcm5U | Ribose | =O | =O | –CH2–CO2CH3 | |||
| 2-Thiouridin | s2U | Ribose | =S | =O | ||||
| 4-Thiouridin | s4U | Ribose | =O | =S | ||||
| Ribothymidin (= 5-Methyluridin) | T, m5U | Ribose | =O | =O | –CH3 | |||
| Dihydrothymidin | Desoxyribose | =O | =O | –H,–CH3 | –H,–H |
Purin-Nukleoside
| Name | Symbol | Purin-Grundstruktur | R1 | R2 | R3 | R4 | R5 | R6 | R7 | R8 | R9 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Adenosin | A | 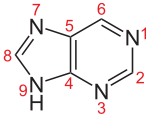 |
–NH2 | Ribose | |||||||
| 1-Methyladenosin | m1A | –CH3 | –NH2 | Ribose | |||||||
| 2-Methyladenosin | m2A | –CH3 | –NH2 | Ribose | |||||||
| N6-Methyladenosin | m6A | –NH–CH3 | Ribose / Desoxyribose | ||||||||
| N6,N6-Dimethyladenosin | m62A | –N(CH3)2 | Ribose | ||||||||
| 2′-O-Methyladenosin | Am | –NH2 | 2′-O-Methyl-ribose | ||||||||
| Inosin | I | =O | Ribose | ||||||||
| 1-Methylinosin | m1I | –CH3 | =O | Ribose | |||||||
| 2′-O-Methylinosin | Im | =O | 2′-O-Methyl-ribose | ||||||||
| Guanosin | G | –NH2 | =O | Ribose | |||||||
| 1-Methylguanosin | m1G | –CH3 | –NH2 | =O | Ribose | ||||||
| 7+-Methylguanosin | m7G | –NH2 | =O | –CH3 | Ribose | ||||||
| N2-Methylguanosin | m2G | –NH–CH3 | =O | Ribose | |||||||
| N2,N2-Dimethylguanosin | m22G | –N(CH3)2 | =O | Ribose | |||||||
| 2′-O-Methylguanosin | Gm | –NH2 | =O | 2′-O-Methyl-ribose | |||||||
| Isoguanosin (synth.) | iG | =O | –NH2 | Ribose |
Hypermodifizierte Nukleoside und mit verändertem Basengrundgerüst
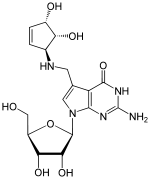 |
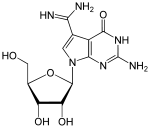 |
| Queuosin (Q, obiges
Bild) β-D-Galactosyl-queuosin (galQ) β-D-Mannosyl-queuosin (manQ) |
Archaeosin (G*, kommt nur in Archaeen vor) |
 |
 |
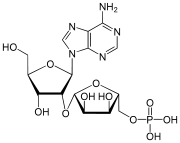
| 2′-O-Ribosyladenosinphosphat
(Ar(p), rAMP) nur in Eukaryoten gefunden |
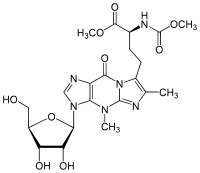
Wybutosin (Y, yW;
obiges Bild) Wyosin (Wyo, imG) |
 |
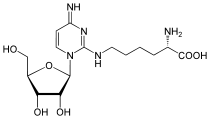 |
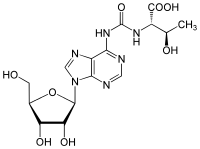
| N6-Threonylcarbamoyladenosin (t6A) | Lysidin (k2C) |
Variationen der Pentosen
| Nukleobase | (Ribosyl)Nukleosid | Desoxynukleosid | Arabinosylnukleosid | (Methylribosyl)Nukleosid |
|---|---|---|---|---|
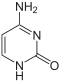 |
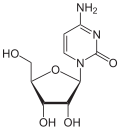 |
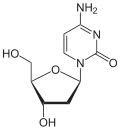 |
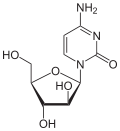 |
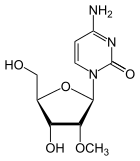 |
| Cytosin | Cytidin, C | Desoxycytidin, dC | Cytarabin, araC | 2′-O-Methylcytidin, Cm |
Physiologie
Wird die Hydroxygruppe des C-5-Atoms der Pentose eines Nukleosids mit Phosphat verestert, entsteht das entsprechende Nukleotid. Je nach Anzahl der Phosphat-Reste spricht man von Mono-, Di- und Triphosphaten. Aus der zentralen Bedeutung der Nukleotide ergibt sich die gleiche Bedeutung für die entsprechenden Nukleoside, da sie als Baustein der Nukleotide in diese umgewandelt werden können.
Die Nukleoside stehen durch Abspaltung der letzten Phosphatgruppe in den Nukleotiden mittels Hydrolyse, mithilfe von Nukleotidase-Enzymen in allen Lebewesen zur Verfügung. Weiterhin kann Inosin aus Adenosin mittels der AMP-Desaminase oder der Guanin-Desaminase synthetisiert werden. Xanthosin ist entsprechend nicht nur durch Hydrolyse von XMP erhältlich, sondern auch aus Guanosin mittels der Guanosin-Desaminase.
Der Abbau erfolgt über Nukleosidasen zur Nukleobase und bei Purinen über Xanthin zur Harnsäure bzw. bei Pyrimidinen zum Alanin oder zur 2-Aminobuttersäure.
Nukleosidanaloga
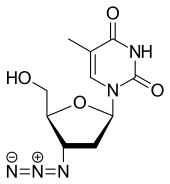
Nukleosidanaloga spielen vor allem in der antiretroviralen Therapie (vgl. AIDS) eine große Rolle. Eine Reihe moderner Virostatika enthalten diese Substanzen. Wohl am besten bekannt ist der Wirkstoff Aciclovir, der häufig gegen Herpes-simplex-Viren (HSV-1 und -2) eingesetzt wird. Weiterhin verbreitet ist Ganciclovir, das genau wie Aciclovir ein Guanosin-Analogon ist, und spezifisch die Replikation von CMV unterdrückt.
Weitere Basenanaloga, die gegen Virusinfektionen verschrieben werden, sind z.B. Zidovudin (auch Azidothymidin, kurz AZT), Stavudin, Zalcitabin, Diadenosin, Idoxuridin, Fluridin und Ribavirin.
Azidothymidin
Azidothymidin (AZT, INN: Zidovudin) war der erste wirksame Arzneistoff gegen das HI-Virus. Da es am 3’-Kohlenstoff der Ribose statt einer Hydroxygruppe eine Azidogruppe aufweist, kann hier bei der Synthese der Virus-DNA die Kette nicht mehr weiterwachsen und es entsteht ein inaktives Provirus.
Einige dieser Medikamente zeigen allerdings auch erhebliche Nebenwirkungen, weshalb sie für eine Langzeittherapie nur bedingt geeignet sind.
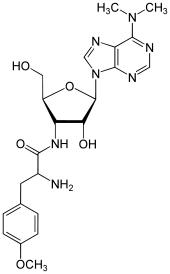
Puromycin
Puromycin (auch Purimycin) ist ein aus dem Bakterium Streptomyces alboniger gewonnenes Nukleosid-Antibiotikum, das die Proteinbiosynthese hemmt und gegen einige Tumore, Amöben, Trypanosomen und Würmer wirksam ist. Da es aber für den Menschen zu giftig ist, wird es nur in Experimenten der Mikrobiologie eingesetzt. Strukturell leitet es sich von Adenosin ab.
Nukleosidanaloga mit Arabinose
Nukleosidanaloga mit Arabinose (Arabinosylnukleoside) werden meist als Zytostatika eingesetzt.
-
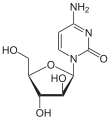 Cytarabin
Cytarabin -
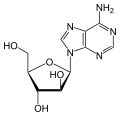 Vidarabin
Vidarabin


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.03. 2025