
Dinatriumhydrogenphosphat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | > 2.000 mg/kg (LD50, Ratte, oral)[5] | ||||||
Dinatriumhydrogenphosphat ist ein Natrium-Salz der Phosphorsäure. Es wird auch als sekundäres Natriumphosphat bezeichnet.
| Strukturformel | ||
|---|---|---|

| ||
| Allgemeines | ||
| Name | Dinatriumhydrogenphosphat | |
| Andere Namen | ||
| Summenformel | Na2HPO4 | |
| Kurzbeschreibung | farblose, hygroskopische, kristalline Substanz[3] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 231-448-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse |
| |
| Aggregatzustand | fest | |
| Dichte | ||
| Schmelzpunkt | ||
| pKS-Wert | 12,32[4] | |
| Löslichkeit | löslich in Wasser (77 g/l bei 20 °C, wasserfreie Substanz)[3] | |
Eigenschaften
Wasserfreies Dinatriumhydrogenphosphat ist eine farblose, kristalline, hygroskopische Verbindung. Neben der wasserfreien Verbindung sind auch drei Hydrate bekannt:[3]
- Dihydrat (Na2HPO4 · 2 H2O)
- Heptahydrat (Na2HPO4 · 7 H2O)
- Dodecahydrat (Na2HPO4 · 12 H2O)
Ein Mol wasserfreies Dinatriumhydrogenphosphat nimmt aus der Luft 2 Mol Wasser auf und bindet es als Kristallwasser. Die höheren Hydrate hingegen verwittern an Luft zum Dihydrat.[6] Diese Stabilität des Dihydrats ist auch der Grund für seine Wahl als Puffersubstanz. Beim Erhitzen wird zunächst alles Kristallwasser abgegeben (Dodecahydrat bei 35 °C, Heptahydrat bei 48 °C und Dihydrat bei 92,5 °C)[3], anschließend (bei ca. 250 °C) aber auch – aus je zwei Molekülen – ein weiteres Wassermolekül, wodurch ein Pyrophosphat entsteht.[7]
Dinatriumhydrogenphosphat reagiert in wässriger Lösung basisch:
Es stellt sich also ein Gleichgewicht zwischen Hydrogen- und Dihydrogenphosphat-Ionen ein.
Synthese
Im Labor kann Natriumhydrogenphosphat aus Natronlauge und Phosphorsäure hergestellt werden.
Verwendung
In der Lebensmitteltechnik wird Dinatriumhydrogenphosphat als Komplexbildner, Säureregulator und Schmelzsalz eingesetzt. Es ist zusammen mit Natriumdihydrogenphosphat und Natriumphosphat in der EU als Lebensmittelzusatzstoff unter der gemeinsamen Nummer E 339 („Natriumphosphate“) für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 bis hin zu 50 Gramm pro Kilogramm (in Getränkeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln und teils bei Kaugummis). Phosphor steht im Verdacht Hyperaktivität, allergische Reaktionen und Osteoporose auszulösen. Es wurde eine erlaubte Tagesdosis von 70 Milligramm pro Kilogramm Körpergewicht für die Gesamtmenge aufgenommener Phosphorsäure und Phosphate festgelegt.
Phosphatpuffer
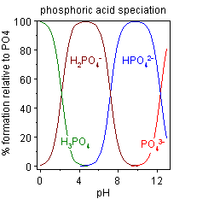
Dinatriumhydrogenphosphat findet in der Biochemie und Molekularbiologie zur Herstellung von Pufferlösungen Anwendung. Durch Mischen von Natriumdihydrogenphosphat- mit Dinatriumhydrogenphosphat-Lösung oder Zugabe von Natronlauge lässt sich ein Phosphatpuffer mit einem bestimmten pH-Wert (pH 6–8) herstellen. Weiterhin ist es Bestandteil von manchen Arzneimitteln als pH-Puffer.
Einzelnachweise
- ↑ Eintrag zu
 DISODIUM PHOSPHATE
in der CosIng-Datenbank der EU-Kommission.
DISODIUM PHOSPHATE
in der CosIng-Datenbank der EU-Kommission.
- ↑ Eintrag zu
 E 339: Sodium phosphates
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
E 339: Sodium phosphates
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
l m Eintrag zu
 Dinatriumhydrogenphosphat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Dinatriumhydrogenphosphat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ Eintrag zu Phosphorsäure. In: Römpp Online. Georg Thieme Verlag.
- ↑ Datenblatt
 di-Natriumhydrogenphosphat ≥ 99%, wasserfrei (PDF) bei
Carl Roth.
di-Natriumhydrogenphosphat ≥ 99%, wasserfrei (PDF) bei
Carl Roth.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 774.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-7776-0672-9, S. 337–338.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025