Polarität (Chemie)
Polarität bezeichnet in der Chemie eine durch Ladungsverschiebung in Atomgruppen entstandene Bildung von getrennten Ladungsschwerpunkten, die bewirken, dass eine Atomgruppe nicht mehr elektrisch neutral ist. Das elektrische Dipolmoment ist ein Maß für die Polarität eines Moleküls.
Polare Stoffe
Ein polarer Stoff besteht aus polaren Molekülen, welche sich durch ein permanentes elektrisches Dipolmoment auszeichnen.
Polare Stoffe lösen sich gut in polaren Lösungsmitteln – wie es beispielsweise bei Salzen in Wasser der Fall ist. Die Löslichkeit ist umso besser, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind.
Bei ausreichend hoher Differenz der Elektronegativität (ΔEN) können die Bindungselektronen nahezu komplett von einem Bindungspartner zum anderen übergehen. Es verbleiben zwei Ionen, die sich nur noch aufgrund der ungerichteten elektrostatischen Coulomb-Kraft anziehen. Ionen, und damit auch alle Salze, sind als Ladungsträger grundsätzlich polar.
Die Polarität eines gesamten Moleküls wird durch polare Atombindungen, oder im Extremfall durch ionische Bindungen hervorgerufen. Polare Bindungen zeichnen sich durch ungleichmäßige Verteilung von Bindungselektronen zwischen den Bindungspartnern aus. Verbinden sich Atome mit unterschiedlicher Elektronegativität, so kann hieraus eine solche Polarisierung der Bindung resultieren. Liegen in einem Molekül nur polarisierte Atombindungen vor, so addieren sich die einzelnen Dipolmomente der Bindungen vektoriell zu einem Gesamtdipolmoment. Ist dieses symmetriebedingt null, so ist der Stoff unpolar (Beispiel: Kohlendioxid, CO2). Liegt jedoch ein permanentes Gesamtdipolmoment ungleich null vor, so ist das Molekül polar (Beispiel: Wassermolekül). Je nach Größe dieses Gesamtdipolmoments ist ein Stoff mehr oder weniger polar. Der Unterschied geht daher fließend von extrem polar bis komplett unpolar. Lösungsmittel werden anhand ihrer Polarität in einer elutropen Reihe geordnet.
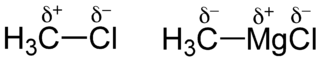
In der organischen Chemie spielen polare Atombindungen eine wichtige Rolle bei der qualitativen Abschätzung der Reaktivität eines Moleküls. In einem Halogenalkan (Beispiel: Chlormethan) wird z.B. dem kovalent an das Kohlenstoffatom gebundene Chloratom die Partialladung δ− und dem Kohlenstoffatom der Methylgruppe die Partialladung δ+ zugewiesen. Setzt man Chlormethan mit Magnesium zur entsprechenden Grignard-Verbindung CH3MgCl um, tritt Umpolung ein: Das Kohlenstoffatom der Methylgruppe besitzt nun die Partialladung δ−. Aus der Polaritätsbetrachtung von organischen Stoffen ergeben sich wesentliche Konsequenzen für deren Reaktivität.
Polare Stoffe: Wasser, Salze, Zucker
Unpolare Stoffe
Ein unpolares oder apolares Molekül dagegen besitzt kein permanentes Dipolmoment.
Unpolare Stoffe lösen sich gut in unpolaren Lösungsmitteln (organische Stoffe in Benzol oder Ether). Die Löslichkeit ist desto besser, je ähnlicher die Wechselwirkungskräfte zwischen den Teilchen des Lösungsmittels und zwischen denen des gelösten Stoffes sind.
Unpolare Stoffe: Benzin, Tetrachlormethan, Wachs, Fett, Alkane, Alkene, Alkine
Das Dipolmoment eines Stoffes bestimmt seine Löslichkeit oder seine Fähigkeit, als Lösungsmittel zu wirken. Dabei gilt die Faustregel, dass polare Stoffe in polaren Lösungsmitteln gut, in unpolaren aber schlecht löslich sind. Umgekehrt sind unpolare Stoffe in unpolaren Lösungsmitteln (z.B. Benzin, Hexan) gut, in polaren aber schlecht löslich. In der mittelalterlichen Alchemie galt der Lehrsatz: „Similia similibus solvuntur“ (lat: „Ähnliches wird von Ähnlichem gelöst“).
Auch sind viele Salze im polaren Lösungsmittel Wasser auf Grund ihrer Ionenstruktur gut löslich, unpolare Stoffe wie Fett oder Wachs dagegen nicht.
Unter anderem sind viele Aromastoffe oder Duftstoffe in Wasser nicht löslich und werden daher in einem Öl oder in Ethanol gelöst. Alkohol ist daher in vielen Lebensmitteln als Zutat aufgeführt.
Bestimmung der Polarität
Experiment zum Nachweis des permanenten elektrischen Dipolmoments von Wasser
Man lädt z.B. einen Kunststoffkamm durch das Kämmen trockener Haare
oder Reiben an einem Wollpullover elektrisch auf. Nun lässt man aus einem
Wasserhahn einen sehr dünnen Strahl fließen, gerade so dass er nicht abreißt und
tropft. Wenn man sich dem Wasserstrahl nun vorsichtig mit dem Kamm nähert, wird
sich dieser zum Kamm hin biegen. Wenn der Wasserstrahl den Kamm jedoch berührt,
wird dieser entladen und zieht den Wasserstrahl nicht mehr an.
Erklärung: Im
konzentrischen elektrischen
Feld, welches den Kamm umgibt, richten sich die Dipole der Wassermoleküle so
aus, dass sie zum Kamm hin zeigen. Da die Feldstärke
mit der Entfernung vom Kamm abnimmt, wirkt auf das dem Kamm nähere Molekülende
eine etwas größere anziehende Kraft als die abstoßende Kraft, welche das weiter
entfernte Molekülende betrifft. In der Differenz verbleibt eine kleine, auf
jedes Wassermolekül anziehend wirkende Kraft, die den Wasserstrahl umlenkt.
Elektronegativität
Um zu bestimmen, ob eine Verbindung unpolar, polar oder sogar eine
Ionenbindung ist, kann man die Elektronegativitätsdifferenz
verwenden. Sie ist die Differenz der Elektronegativitätswerte der beteiligten
Atome. Richtwerte für diese Einteilung sind in der unten dargestellten Tabelle
zu sehen.
Dabei muss allerdings berücksichtigt werden, dass ladungsgetrennte mesomere Grenzformeln ein nicht zu vernachlässigendes Gewicht haben können. So ist Kohlenmonoxid trotz einer Elektronegativitätsdifferenz von etwa 1 ein nahezu unpolares Gas, das erst unterhalb von −140 °C durch Druck verflüssigt werden kann.
| Bindungsart | Kennzeichen der Bindung | |
|---|---|---|
| 0,0 | unpolare Bindung | Elektronenpaare werden von allen Atomen gleich stark beansprucht, sodass keine Ladungsschwerpunkte entstehen. |
| 0,1…0,4 | schwach polare Bindung | Ein Atom beansprucht Elektronenpaare etwas stärker als das andere. |
| 0,4…1,7 | stark polare Bindung | Ein Atom beansprucht Elektronenpaare viel stärker als das andere. |
| > 1,7 | Ionenbindung | Es sind keine gemeinsamen Elektronenpaare vorhanden, d.h., es bilden sich Ionen |
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 24.01. 2024