
Zinksulfid
| Sicherheitshinweise | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||
Zinksulfid (genauer Zink(II)-sulfid; Summenformel ZnS) ist das Zink-Salz der Schwefelwasserstoffsäure. Es kommt in der Natur mineralisch als kubischer Sphalerit (Zinkblende) und hexagonaler Wurtzit vor und kann bergmännisch abgebaut werden. Sowohl in Sphalerit als auch im Wurtzit sind die Zink-Ionen tetraedrisch von vier Sulfid-Ionen umgeben und umgekehrt. Beide Kristallstrukturen sind Prototypen für eine ganze Reihe von Verbindungen. Wurtzit stellt die Hochtemperatur-Modifikation dar. Zinksulfid ist ein II-VI-Verbindungshalbleiter (EG= 3,54 eV, bei Raumtemperatur).
| Kristallstruktur | |
|---|---|
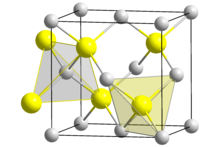 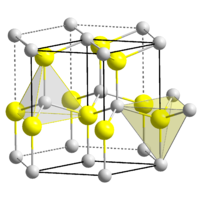 | |
| Kristallstrukturen des Zinksulfids,
ZnS links: Sphalerit (kubisch); rechts: Wurtzit
(hexagonal) | |
| Allgemeines | |
| Name | Zinksulfid |
| Andere Namen |
|
| Verhältnisformel | ZnS |
| CAS-Nummer | 1314-98-3 |
| PubChem | 14821 |
| Kurzbeschreibung | weißes, geruchsloses Pulver |
| Eigenschaften | |
| Molare Masse | 97,46 g/mol |
| Aggregatzustand | fest |
| Dichte |
|
| Löslichkeit |
|
Herstellung
Zinksulfid kann durch Oxidation von Zink mit Schwefel hergestellt werden:
Es entsteht auch bei der Umsetzung wässriger Lösungen von Zinksalzen mit Ammoniumsulfid-Lösung als weißer bis schwach gelber amorpher Niederschlag.
Ebenfalls möglich ist die Herstellung durch Reaktion einer Zinksulfatlösung mit Schwefelwasserstoff bei Zugabe von Ammoniumacetat
oder die Reaktion Zinkoxid und Schwefel in ammoniakalischem Medium.
Eigenschaften
Reines Zinksulfid ist ein weißes Pulver, welches in zwei polymorphen Kristallformen auftreten kann. Die α-Form bildet ein kubisches Gitter und kommt in der Natur als Sphalerit (Zinkblende, α-ZnS) vor. Die Umwandlung in die ebenfalls in der Natur vorkommenden β-Modifikation Wurtzit (β-ZnS) beginnt bei 1185 °C und ist bei 1200 °C abgeschlossen. Wurtzit kristallisiert in einem hexagonalen Kristallgitter. Sie zeigt bei Normaldruck keinen Schmelzpunkt und sublimiert bei 1185 °C. Bei einem hohen Druck von 15 MPa liegt der Schmelzpunkt bei 1850 °C.
Ab 480 °C erfolgt in Gegenwart von Luft eine Oxidation zu Zinkoxid und Schwefeldioxid.
Verwendung
Mit Al3+- und Cu+-Ionen dotiertes Zinksulfid zeigt Lumineszenz und wird für Leuchtschirme in Bildröhren, Magische Augen und nachleuchtende Zifferblätter von Uhren verwendet. Ebenso kommt es in Elektrolumineszenz-Folien zur Anwendung. Alternativ ist eine Dotierung mit Silberionen möglich.
In der Malerei wird es zusammen mit Bariumsulfat als Weißpigment genutzt, eine gemeinsam gefällte Form wird als Lithopone bezeichnet. Nachteilig für die Anwendung als Pigment ist die eingeschränkte Beständigkeit von ZnS speziell bei Außenanwendungen. Sauerstoff oxidiert ZnS langsam zu löslichem Zinksulfat.
Wegen seines hohen Brechungsindex von 2,37 werden dünne, im Vakuum aufgedampfte ZnS-Filme zur Vergütung von optischen Bauteilen verwendet.
Zinksulfid ist über breite Bereiche des technisch genutzten Infrarot-Spektrums transparent und wird deshalb zunehmend für Infrarot-Optiken (IR-Kameras) und Schutzgläser eingesetzt. Dabei ist es günstiger als die Alternativen Germanium und Zinkselenid und auch aus toxikologischer Sicht weniger kritisch. Aufgrund des hohen Brechungsindex geht beim Durchgang durch ein unvergütetes ZnS Fenster rund 30 % der IR-Intensität durch Reflexion an den Grenzflächen verloren. Deshalb werden solche Fenster und Optiken meist aufwändig entspiegelt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.12. 2024