Spezifische Wärmekapazität
| Physikalische Größe | |||||||
|---|---|---|---|---|---|---|---|
| Name | spezifische Wärmekapazität | ||||||
| Formelzeichen | |||||||
| |||||||
Die spezifische Wärmekapazität, auch spezifische Wärme oder verkürzt Wärmekapazität, ist eine Stoffeigenschaft der Thermodynamik. Sie bemisst die Fähigkeit eines Stoffes, thermische Energie zu speichern.
Definition
Definition der spezifischen Wärmekapazität
Die spezifische Wärmekapazität eines Stoffes in einem bestimmten Zustand ist die Wärme, die einer Menge des Stoffes zugeführt oder entzogen wird, dividiert durch die zugehörige Temperaturerhöhung oder -erniedrigung und die Masse des Stoffes:
Dabei ist
die Wärme, die dem Stoff zugeführt oder entzogen wird,
die Masse des Stoffes,
die Differenz von End- und Anfangstemperatur.
Die Einheit der spezifischen Wärmekapazität ist im Internationalen Einheitensystem (SI):
Beispielsweise beträgt die spezifische Wärmekapazität von flüssigem Wasser .
Das bedeutet, dass man einem Kilogramm
Wasser eine Energie von 4,182 Kilojoule zuführen
muss, um es um 1 Kelvin
zu erwärmen.
Im Allgemeinen ist die spezifische Wärmekapazität von Zustandsgrößen
insbesondere von der Temperatur abhängig. Daher gelten Werte für die spezifische
Wärmekapazität nur für eine bestimmte Temperatur, häufig für 25 °C.
Messungen der Temperaturabhängigkeit
erfolgen z.B. durch dynamische
Leistungs(differenz)kalorimetrie. Historisch haben solche Messungen,
insbesondere bei tiefen Temperaturen, die Festkörperphysik
wesentlich vorangebracht.
Bei einem Phasenübergang
erster Ordnung ist die Wärmekapazität nicht definiert, Messwerte divergieren
dort. Ein Sprung in
zeigt dagegen einen Phasenübergang zweiter Ordnung an, bei dem sich die Anzahl
von Freiheitsgraden im Material ändert.
Zudem ist die spezifische Wärmekapazität von der Prozessführung
der Erwärmung bzw. Abkühlung abhängig, vor allem bei Gasen.
Insbesondere wird zwischen der spezifischen Wärme bei konstantem Volumen
und der bei konstantem Druck
unterschieden. Bei konstantem Volumen kommt die gesamte Wärmezufuhr der
Temperaturerhöhung zugute. Wenn sich das Gas jedoch ausdehnen kann, dann wird
ein Teil der Wärme für die Verrichtung der Expansionsarbeit
aufgewendet und fehlt damit für die Temperaturerhöhung.
Mittlere und wahre spezifische Wärmekapazität
Die Formel der Einleitung gibt die mittlere spezifische Wärmekapazität
für das Temperaturintervall
an. Diese lässt sich
- für Temperaturbereiche, die zwischen
und einer beliebigen Temperatur
liegen, aus Tabellenwerken ablesen oder, falls sie dort nicht aufgeführt ist, aus ihnen durch Interpolation annähern;
- für Temperaturbereiche, die nicht bei
beginnen, wie folgt berechnen:
Für genauere Betrachtungen ist zur wahren spezifischen Wärmekapazität
bei der Temperatur
überzugehen, d.h. zum Grenzfall beliebig kleiner Temperaturänderungen:
Werte für ausgewählte Materialien
| Material | c in kJ/(kg·K) | Material | c in kJ/(kg·K) | |
|---|---|---|---|---|
| Feststoffe | Gase (cp) | |||
| Eis (0 °C) | 2,060 | Wasserstoff | 14,32 | |
| Eis (−10 °C) | 2,22 | Helium | 5,193 | |
| Natrium | 1,234 | Methan | 2,158 | |
| Magnesium | 1,046 | Wasserdampf (100 °C) | 2,080 | |
| Aluminium | 0,896 | Butan | 1,658 | |
| Eisen | 0,452 | Neon | 1,030 | |
| Kupfer | 0,382 | Luft (20 °C trocken) | 1,005 | |
| Silber | 0,235 | Argon | 0,523 | |
| Blei | 0,129 | Baustoffe | ||
| Flüssigkeiten | Beton | 0,88 | ||
| Wasser (20 °C) | 4,182 | Gips, Schamotte | ≈1 | |
| Ethanol | 2,43 | Holzfaserdämmstoff, Zelluloseflocken | 2,1 | |
| Petroleum | 2,14 | Polystyrol | 1,4 | |
| Quecksilber | 0,139 | Mineralfaserdämmstoff | 0,8 | |
Beziehungen zu Wärmekapazität und molarer Wärmekapazität
Ändert sich die Temperatur eines Körpers
um die Temperaturdifferenz ,
so wird dabei die Wärme
übergeben, vorausgesetzt, die Wärmekapazität
des Körpers ist in diesem Temperaturintervall zumindest näherungsweise
temperaturunabhängig. Im Gegensatz zur Volumen-
oder Masse-bezogenen Wärmekapazität ist die (absolute) Wärmekapazität keine
Stoffeigenschaft, sondern die Eigenschaft eines Körpers.
Handelt es sich um einen homogenen Körper, so kann man auch die Masse-spezifische Wärmekapazität angeben:
Bezieht man die Wärmekapazität nicht auf die Masse des Stoffes, sondern auf
seine Stoffmenge ,
so lautet obige Gleichung unter Verwendung der molaren Wärmekapazität
(veraltet auch Molwärme genannt):
Zwischen der Wärmekapazität ,
der spezifischen Wärmekapazität
und der molaren Wärmekapazität
besteht der Zusammenhang
.
Nach Division durch die Stoffmenge
wird daraus
mit der molaren
Masse .
Am Beispiel Kupfer ergibt sich:
Wärmekapazität idealer Gase
Aus den thermodynamischen Zustandsgleichungen des idealen Gases
und der Definition der Enthalpie:
folgt für die molaren Wärmekapazitäten bei konstantem Volumen
(isochor)
und bei konstantem Druck
(isobar):
mit der universellen
Gaskonstante .
Gegenüber der molaren Wärmekapazität bei konstantem Volumen fällt diejenige bei konstantem Druck größer aus, weil das Gas in diesem Fall beim Erwärmen expandiert und damit gegen den Außendruck Arbeit leistet. Der entsprechende Anteil der zugeführten Wärme kommt nicht der inneren Energie des Gases und damit auch nicht der Temperaturerhöhung zugute. Deshalb muss für eine bestimmte Temperaturerhöhung mehr Wärme zugeführt werden, der Quotient und damit die molare Wärmekapazität vergrößern sich.
Der Isentropenexponent ist definiert als:
Allgemeiner Fall
In guter Näherung gilt:
- mit
und
folgt
.
mit der Gesamtzahl
der energetischen Freiheitsgrade
eines Moleküls mit den Anteilen
für die translatorische kinetische Energie des Schwerpunkts
für die Rotationsenergie (Erläuterung s.u.)
für die innere Energie der
Normalschwingungen der Atomkerne gegeneinander (jede Schwingung bringt einen zusätzlichen Freiheitsgrad für die kinetische Energie und einen für die potentielle Energie).
1-atomiges Gas
Das einfachste Modellsystem betrachtet die Atome als Massepunkte:
von ihnen (Teilchenzahl)
fliegen in einem Kasten mit Volumen
frei umher und üben durch Stöße
gegen die Wand einen Druck
aus. Im zeitlichen Mittel ergibt sich nach der kinetischen
Gastheorie für den Druck auf die Wand die Gleichung:
Darin ist
die durchschnittliche kinetische Energie eines Teilchens.
Für die gesamte kinetische Energie
aller Teilchen ergibt sich durch Vergleich mit der Zustandsgleichung
des idealen Gases:
Dieses Ergebnis folgt auch aus dem Gleichverteilungssatz
der statistischen
Mechanik, nach dem jedes Teilchen in jedem seiner Freiheitsgrade der
Bewegung im Durchschnitt die Energie
besitzt; mit den drei Freiheitsgraden des einatomigen Gases ergibt sich:
mit
- der Boltzmann-Konstante
- der Avogadro-Konstante
.
Der Massepunkt hat
Freiheitsgrade, entsprechend den drei Raumdimensionen. Zwar
kann ein einzelnes Atom auch rotieren in dem Sinn, dass es in seinen angeregten
Zuständen höheren Drehimpuls
hat als im Grundzustand.
Diese Zustände entsprechen elektronischen Anregungen und haben Anregungsenergien, die
aufgrund der Kleinheit des Massenträgheitsmoments
wegen der Drehimpulsquantelung
bei mindestens einigen eV
liegen, also weit höher als die typische thermische
Energie
,
sodass im thermischen
Gleichgewicht keine Anregung erfolgen kann
.
Identifiziert man die thermodynamische innere
Energie
mit der gesamten kinetischen Energie, so folgt die kalorische Zustandsgleichung
des einatomigen idealen Gases:
Folglich ist
Größerer Temperaturbereich
Diese Werte stimmen mit Messungen an Edelgasen
und an Quecksilberdampf hervorragend überein, wenn
die Temperatur bzw. der Druck genügend weit über dem Verflüssigungspunkt
liegt. Die erste Messung erfolgte im Jahr 1876 an dünnem Quecksilberdampf bei
etwa 300 °C. Der über die Schallgeschwindigkeit
bestimmte Isentropenexponent
bestätigte erstmals, dass freie
Atome sich über einen großen Temperaturbereich wie Massepunkte verhalten.
2-atomiges Gas
Das einfachste Modell für ein zweiatomiges Gas ist eine starre Hantel .
Sie hat
Freiheitsgrade für Translationsbewegungen
des Schwerpunkts
und
Freiheitsgrade für Rotationen
um die beiden Achsen senkrecht zur Hantelachse; die (im makroskopischen
mechanischen Modell gegebene) Möglichkeit der Rotation um die Hantelachse wird
nicht mitgezählt, da beide Atomkerne auf der Rotationsachse liegen. Daher
besitzen sie – wie beim einatomigen Gas – um diese Achse kein
Massenträgheitsmoment und damit auch keine Rotationsenergie.
Mit den o. g.
Freiheitsgraden folgt aus dem Gleichverteilungssatz:
Folglich ist
Hierzu passen Messwerte für Sauerstoff, Stickstoff, Wasserstoff etc. unter Normalbedingungen hervorragend.
Bei sehr niedrigen Temperaturen
Bei sehr kaltem Wasserstoff
wird eine Abnahme der Molwärme bis auf
beobachtet, was dem Verhalten eines einzelnen Massepunkts entspricht. Dies wird
erklärt durch den quantenphysikalischen
Effekt, dass die Rotationsenergie nur diskrete
Werte mit bestimmten Abständen annehmen kann (Energiestufen, Quantelung). Bei tiefen
Temperaturen kann die Größenordnung
der Energien, die typischerweise bei Stößen zwischen den Molekülen ausgetauscht
werden (näherungsweise gegeben durch die thermische Energie
),
unter die niedrigste Stufe der Rotationsenergie sinken:
In diesem Fall können durch die thermischen Stöße keine Rotationen mehr angeregt werden, die Rotationsfreiheitsgrade „frieren ein“, weshalb zweiatomige Gase bei tiefen Temperaturen modellmässig wie einatomige Gase behandelt werden können:
Dieser Effekt ist am deutlichsten ausgeprägt bei Wasserstoff, der bis zu sehr
tiefen Temperaturen gasförmig bleibt und dessen Moleküle das kleinste
Trägheitsmoment und damit auch die geringste Rotationsenergie haben ().
Bei sehr hohen Temperaturen
Bei höheren bzw. sehr hohen Temperaturen können die Molwärmen steigen bis gegen:
Das wird erklärt durch das allmähliche „Auftauen“ der Freiheitsgrade für die Schwingung der beiden Atome gegeneinander, d.h., das Modell der starren Hantel gilt bei hohen Temperaturen nicht mehr:
3- und mehratomiges Gas
Translations- und Rotationsbewegungen bringen je drei Freiheitsgrade:
sofern nicht alle Kerne auf einer Linie liegen (dann gibt es nur zwei Rotationsfreiheitsgrade, Erläuterung s.o. bei zweiatomigem Gas).
Bei größeren Molekülen sind auch Teile der Schwingsfreiheitsgrade schon bei Normalbedingungen angeregt:
Dadurch steigen die Molwärmen höher als bei den 2-atomigen Gasen:
weshalb der Isentropenexponent
weiter fällt:
Wärmekapazität von Festkörpern
Beobachtungen
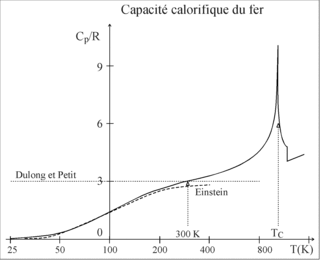
Die molare Wärme von Festkörpern erreicht nach dem empirisch gefundenen Dulong-Petit-Gesetz bei genügend hohen Temperaturen näherungsweise den gleichen Wert:
Zu niedrigen Temperaturen hin nimmt die spezifische Wärme ab, wobei die Form
dieser Abhängigkeit für alle Festkörper sehr ähnlich ist, wenn die Temperatur
geeignet skaliert
wird. Bei sehr tiefer Temperatur nähert die spezifische Wärme sich dem Wert
Null, dabei ähnelt der Verlauf für Nichtleiter
der Funktion ,
für Metalle
der Funktion
.
Bei ferromagnetischen Materialien wie z.B. Eisen liefert die Änderung der
Magnetisierung einen Beitrag zur Wärmekapazität.
Modellsystem Massepunkte
Das einfachste Modellsystem des Festkörpers besteht aus
Massepunkten, die durch elastische
Kräfte an ihre Ruhelage
gebunden sind und unabhängig voneinander in jeweils drei Richtungen des Raumes
schwingen können. Da jede Schwingung zwei Freiheitsgrade beisteuert, ist die
Gesamtzahl der Freiheitsgrade
und die nach dem Gleichverteilungssatz
vorhergesagte molare Wärmekapazität
was mit der Regel von Dulong-Petit übereinstimmt.
Einstein-Modell
Die Abnahme zu tieferen Temperaturen hin zeigt das Einfrieren der
Schwingungen. Albert Einstein nahm 1907 an, dass die Schwingungen aller Teilchen dieselbe Frequenz
haben und ihre Energie sich nur stufenweise um jeweils
ändern kann (
ist das Plancksche
Wirkungsquantum).
Debye-Modell
| Metall | Debye- Temperatur |
|---|---|
| Eisen | 464 K |
| Aluminium | 426 K |
| Magnesium | 406 K |
| Kupfer | 345 K |
| Zinn | 195 K |
| Blei | 96 K |
Peter Debye verfeinerte das Modell 1912 dahingehend, dass er statt von
unabhängigen, individuellen Schwingungen der einzelnen Atome
von den elastischen Schwingungen des ganzen Körpers ausging. Bei hoher
Temperatur sind sie nach dem Gleichverteilungssatz alle angeregt und ergeben die
spezifische Wärme in Übereinstimmung mit dem Wert .
Sie haben aber je nach Wellenlänge
verschiedene Frequenzen, sodass ihre Energiestufen unterschiedlich weit
auseinanderliegen und sich daher der Effekt des Einfrierens über einen weiteren
Temperaturbereich verteilt. Nach diesem Debye-Modell wird die molare
Wärmekapazität in Abhängigkeit von der Temperatur bestimmt:
Die Debye-Temperatur
als einzige vom Material abhängige Größe gibt den Wert an, mit dem die
Temperatur zu skalieren ist, um eine für alle Stoffe einheitliche Kurve zu
erhalten: etwa bei der Temperatur
ist die molare Wärme auf die Hälfte ihres vollen Werts abgefallen.
Das Debye-Modell stimmt bei allen Temperaturen mit den Messungen an
Festkörpern sehr gut überein. Es ergibt insbesondere auch in der Nähe des absoluten
Nullpunkts richtig das Anwachsen der Wärmekapazität mit
bei Nichtleitern, während das Einstein-Modell
hier ein viel zu schwaches Anwachsen vorhersagt.
Modellsystem Elektronengas
Um die lineare Abhängigkeit der Wärmekapazität von der Temperatur zu verstehen, die die elektrischen Leiter in der Nähe des absoluten Nullpunkts zeigen, kann man die Leitungselektronen als entartes Fermigas auffassen. Mit Hilfe der Fermiverteilung und der Zustandsdichte eines freien Elektrons lässt sich daraus für niedrige Temperaturen die Temperaturabhängigkeit der Gesamtenergie und folglich auch die Wärmekapazität berechnen.
Das Ergebnis stimmt mit den Messwerten überein und ist weit geringer, als
wenn man die Leitungselektronen als klassisches einatomiges ideales Gas (wie
oben) betrachtete, das sich zusätzlich zu den Atomrümpfen
im Festkörper befindet. Die Aufklärung dieser Diskrepanz von
gilt als ein wesentlicher Fortschritt in der Festkörperphysik
der ersten Hälfte des 20. Jahrhunderts.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 19.11. 2021