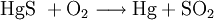Quecksilber
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 0,005 ml/m3 bzw. 0,05 mg/m3 | ||||||||
| Toxikologische Daten | |||||||||
Quecksilber (altgr. ὑδράργυρος Hydrargyros ,flüssiges Silber, davon abgeleitet das lat. Wort hydrargyrum (Hg), Name gegeben von Dioskurides) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Hg und der Ordnungszahl 80. Obwohl es eine abgeschlossene d-Schale besitzt, wird es häufig zu den Übergangsmetallen gezählt, im Periodensystem steht es in der 2. Nebengruppe (Gruppe 12) oder Zinkgruppe. Es ist das einzige Metall und neben Brom das einzige Element, das bei Standardbedingungen flüssig ist. Aufgrund seiner hohen Oberflächenspannung benetzt Quecksilber seine Unterlage nicht, sondern bildet wegen seiner starken Kohäsion linsenförmige Tropfen. Es ist wie jedes andere Metall elektrisch leitfähig.
Geschichte
Quecksilber ist mindestens seit der Antike bekannt. So wird es schon in den Werken von Aristoteles, Plinius dem Älteren und anderen Schriftstellern der Antike erwähnt. Im Altertum wurde es als Heilmittel verwendet (aufgrund seiner Toxizität jedoch mit entsprechend negativen Folgen).
In der griechischen Antike symbolisierte das Quecksilber den Gott und den Planeten Merkur. Dies wurde von den Römern und den Alchemisten übernommen. Daher ist im Englischen mercury sowohl die Bezeichnung für das Quecksilber, als auch für den Planeten und den Gott.
Für die mittelalterlichen Alchemisten waren Quecksilber, Schwefel und Salz die drei grundlegenden Elemente. Das Einhorn symbolisierte das Quecksilber.
Am Quecksilber wurde vom niederländischen Physiker Heike Kamerlingh Onnes im Jahre 1911 das erste Mal das Phänomen der Supraleitung entdeckt. Ab einer Temperatur von 4,2 Kelvin (-268,9 Grad Celsius) verschwindet dabei der elektrische Widerstand vollständig.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Quecksilber, Hg, 80 |
| Serie | Übergangsmetalle |
| Gruppe, Periode, Block | 12, 6, d |
| Aussehen | silbrig weiß |
| CAS-Nummer | |
| EG-Nummer | 231-106-7 |
| ECHA-InfoCard | |
| ATC-Code | |
| Massenanteil an der Erdhülle | 0,4 ppm |
| Physikalisch | |
| Aggregatzustand | flüssig |
| Dichte | 13,5459 g/cm3 bei 293,15 K |
| Mohshärte | 1,5 |
| Magnetismus | diamagnetisch (χm = -2,8 · 10-5) |
| Schmelzpunkt | 234,32 K (-38,83 °C) |
| Siedepunkt | 629,88 K (356,73 °C) |
| Molares Volumen | (fest) 14,09 · 10-6 m3/mol |
| Verdampfungswärme | 59,2 kJ/mol |
| Schmelzwärme | 2,29 kJ/mol |
| Dampfdruck | 0,163 Pa bei 293 K |
| Schallgeschwindigkeit | 1407 m/s bei 293,15 K |
| Spezifische Wärmekapazität | 140 J/(kg · K) |
| Elektrische Leitfähigkeit | 1,04 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 8,3 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 1, 2, 4 |
| Oxide> (Basizität) | Hg2O, HgO (leicht basisch) |
| Normalpotential | 0,8535 V (Hg2+ + 2e− → Hg) |
| Elektronegativität | 2,00 (Pauling-Skala) |
Vorkommen
Quecksilber kommt in reiner Form in der Natur vor und ist als einzige flüssige Substanz aus Tradition als Mineral von der International Mineralogical Association (IMA) anerkannt.
Quecksilbervorkommen gibt es unter anderem in Serbien, Italien, China, Algerien, Russland und Spanien. Meist findet man es als Mineral in Form von Zinnober (HgS) in Gebieten mit ehemaliger vulkanischer Aktivität. Seltener kommt Quecksilber auch gediegen vor. Im spanischen Ort Almadén befinden sich die größten Zinnober-Vorkommen der Erde. Die Förderung wurde im Jahr 2000 beendet und die Minen zu touristischen Attraktionen umgearbeitet. Weit seltenere Quecksilberminerale sind Montroydit (HgO), Paraschachnerit, Schachnerit, Eugenit, Luanheit und Moschellandsbergit (alle AgHg). Ein anderes Mineral ist Belendorffit (CuHg).
Gewinnung und Darstellung
Reines Quecksilber wird gewonnen, indem man das Quecksilbererz Zinnober (HgS) mit Sauerstoff reagieren lässt (Röstverfahren).
Eigenschaften

Quecksilber ist ein silberweißes, flüssiges Schwermetall. Es wird manchmal noch zu den Edelmetallen gezählt, ist jedoch viel reaktiver als die klassischen Edelmetalle (zum Beispiel Platin, Gold), die in derselben Periode stehen. Es bildet mit sehr vielen Metallen Legierungen, die sogenannten Amalgame. Quecksilber leitet Strom im Vergleich zu anderen Metallen schlecht und verdunstet schon bei Raumtemperatur. Es ist außer den Edelgasen das einzige Element, das in der Gasphase einatomig vorliegt.
Quecksilber ist etwa 13,5-mal so dicht wie Wasser, sodass nach dem Archimedischen Prinzip seine Tragfähigkeit auch 13,5-mal so hoch ist; somit schwimmt auch ein Eisenwürfel (Dichte etwa 7,87-mal so hoch wie die von Wasser) in Quecksilber.
Aggregatzustand
Die Antwort auf die Frage, warum Quecksilber flüssig ist, findet sich in der Betrachtung der Bindung zwischen den Quecksilberatomen. Quecksilber hat eine einmalige Elektronenkonfiguration, die keine stabile Bindung zwischen den einzelnen Atomen zulässt. Die Atome aller anderen bei Raumtemperatur festen Metalle werden durch das sogenannte Elektronengas elektrostatisch zusammengehalten, welches aus delokalisierten Elektronen der äußeren Schale der Atome besteht.
Die Metallbindung elementarer Metalle kommt durch so genannte Bänder zustande, welche sämtliche Elektronen eines Energieniveaus enthalten. Solche Bänder werden benötigt, um das Pauli-Prinzip zu erfüllen. Bei der Metallbindung springen Elektronen vom Valenzband, dem energetisch am höchsten liegenden mit Elektronen vollbesetzte Band, ins Leitungsband, dem nicht komplett aufgefüllten Band, und zurück. Dadurch werden die Metallatome eine Art schwacher Kationen, die durch die negative Ladung der ferneren Elektronen - auch "Elektronengas" - zusammengehalten werden. Zugleich sind die Elektronen beweglich genug um als Ladungsträger für elektrischen Strom zu dienen, was die elektrische Leitfähigkeit von Metallen erklärt.
Als Element der 12. Gruppe des Periodensystem besitzen Quecksilberatome komplett gefüllte s- und d-Orbitale, was eine sehr stabile und energetisch günstige Konstellation bedeutet. Das Leitungsband ist dadurch leer. Bei den leichteren Homologen Zink und Cadmium, die in derselben Gruppe des PSE wie Quecksilber stehen, jedoch bei Raumtemperatur fest sind, ist der energetische Unterschied zwischen dem Valenzband zum Leitungsband so gering, dass Elektronen problemlos vom Valenz- ins Leitungsband springen können, wodurch eine Metallbindung zustande kommt.
Die Besonderheit bei Quecksilber liegt in den mit 14 Elektronen vollständig gefüllten 4f-Orbitalen, welche bei Zink und Cadmium zwar vorhanden, jedoch nicht besetzt sind. Während Zink und Cadmium jeweils 12 Elektronen in der äußersten Schale haben, hat Quecksilber 26 darin. Aufgrund der Lanthanoidenkontraktion und des relativistischen Effekts kommt es zu einem Massezuwachs und einer weniger effizienten Abschirmung der Kernladung.
Besetzte Orbitale werden so näher an den Kern herangezogen, sowie auch das Valenzband des Quecksilbers. Unbesetzte Orbitale, das Leitungsband, werden nicht näher an den Kern gezogen, was zu einer besonders großen Energiedifferenz zwischen Valenz- und Leitungsband führt, die bei Zink und Cadmium deutlich geringer ist. So können kaum Elektronen das Valenzband verlassen, wodurch die Metallbindung außergewöhnlich schwach ausfällt. Dies erklärt zugleich auch die Flüchtigkeit und die für Metalle untypische schlechte Leitfähigkeit des Quecksilbers.
Isotope
Von Quecksilber sind insgesamt 34 Isotope und 9 Kernisomere mit Massenzahlen von 175 bis 208 bekannt. 7 dieser Isotope sind stabil (mit den Massen 196, 198, 199, 200, 201, 202 und 204). Von den radioaktiven Isotopen weist nur 194Hg mit 444 Jahren eine relativ lange Halbwertszeit auf. Die anderen Isotope und Kernisomere haben nur Halbwertszeiten zwischen 1,1 Millisekunden und 46,612 Tagen.
Verwendung
Thermometer
Die thermische Ausdehnung des Quecksilbers ist recht hoch und zwischen 0 °C und 100 °C direkt proportional zur Temperatur. Außerdem benetzt Quecksilber Glas nicht. Daher eignet es sich zum Einsatz in Flüssigkeitsthermometern und Kontaktthermometern.
Bedingt durch seine starke Toxizität ist der Einsatz heutzutage auf den wissenschaftlichen Bereich beschränkt, es kann teilweise durch gefärbten Alkohol oder Galinstan oder elektronische Thermometer ersetzt werden.
Das erste brauchbare Quecksilberthermometer wurde um 1720 von Daniel Gabriel Fahrenheit entwickelt. In einem Thermometer befinden sich im Schnitt 150 mg Quecksilber. In einem Fieberthermometer kann die Menge bis zu 1 g betragen. Dies entspricht in etwa einem Kügelchen von 5,2 mm Durchmesser.
Seit dem 3. April 2009 ist das Inverkehrbringen von neuen quecksilberhaltigen Fieberthermometern, Barometern und Blutdruckmessgeräten innerhalb der EU verboten; ausgenommen hiervon sind Messgeräte für den wissenschaftlichen oder medizinischen Gebrauch sowie Alt- und Gebrauchtgeräte.
Manometer/Barometer

Die klassische Bauform eines Manometers ("Druckdifferenzmessers") ist ein U-Rohr, dessen Enden mit den beiden Druckatmosphären über Leitungen verbunden sind. Bis in die heutige Zeit ist Quecksilber als Manometerflüssigkeit weit verbreitet.
Die alte Bauform des Barometers ist ein U-förmiges, aufrecht stehendes Rohr, welches auf einer Seite oben geschlossen ist; damit ist es eine Sonderbauform des Manometers.
Die Quecksilbersäule in der geschlossenen Hälfte sinkt nur soweit ab, bis der Luftdruck und die Gewichtskraft des Quecksilbers sich im Kräftegleichgewicht befinden. Bei Normaldruck (1 Atmosphäre) sind dies 760 mm. Die alte Angabe in der Maßeinheit Torr für den Luftdruck entspricht der Höhe der Quecksilbersäule in Millimetern, 1 mm Quecksilbersäule entsprechen 133,21 Pa.
Schalter
Durch seine elektrische Leitfähigkeit und die sehr hohe Oberflächenspannung (0,476 N/m bei 20 °C) ist Quecksilber ideal für die Anwendung als Kontaktwerkstoff in den früher verwendeten Quecksilberschaltern. Wegen der Problematik bei der Entsorgung von Elektronikschrott ist seit dem Jahr 2005 in der EU ("RoHS"-Richtlinie) der Einsatz von Quecksilber in Schaltern für die meisten Anwendungsgebiete untersagt. In Spezialanwendungen werden auch heute noch mit Quecksilber benetzte Kontakte verwendet, um besonders geringe Kontaktwiderstände zu erzielen oder das Kontaktprellen zu vermeiden (z. B. Hg-Relais).
Quecksilber-Neigungsschalter funktionieren im Prinzip wie eine Wasserwaage; ein Quecksilbertropfen in einem gebogenen Glasrohr öffnet und schließt neigungsabhängig einen elektrischen Kontakt. Solche Neigungsschalter finden sich teilweise in alten Treppenlichtautomaten, wo sie einen verschleißfreien Schalter darstellen. In alten Wechselrichtern (Turbowechselrichter) wurde ein Quecksilberstrahl als "Schalter" benutzt.
Quecksilberdampflampen

Quecksilber wird in Entladungsgefäßen (Quecksilberdampflampen) von Gasentladungslampen (Leuchtstofflampen, "Energiesparlampen", Kaltkathodenröhren, Quecksilberdampf-Hochdruck- und -höchstdrucklampen, Höhensonne, Quarzlampe, sog. "Schwarzlichtlampe") eingesetzt.
Amalgam
Quecksilber bildet mit anderen Metallen spontan Amalgame. Amalgame werden z. B. als Zahnfüllmittel eingesetzt. Da Quecksilber durch Amalgambildung die schützende Oxidhaut des Aluminiums zerstört, ist das Mitführen von quecksilberhaltigen Geräten (z. B. Fieberthermometer) in Flugzeugen nicht verboten aber gemäß der International Air Transport Association (IATA) Dangerous Goods Regulations beschränkt (1 Stück / Passagier und zwingend in Schutzhülle - DGR 2.3). Quecksilber ist der Gefahrgutklasse 8 - Ätzende Materialien zugeordnet. Eine ätzende Wirkung besteht allerdings nur in Verbindung mit Aluminium - einem Leichtmetall, das im Flugzeugbau verwendet wird.
Desinfektions- und Beizmittel
In dem Wunddesinfektionsmittel Mercurochrom war der wirksame Bestandteil ein organisches Quecksilbersalz. Die heute erhältliche Mercuchrom-Jod-Lösung ist eine Povidon-Jod-Lösung. In Merfen>, einem weiteren Desinfektionsmittel, war früher Phenylquecksilberborat enthalten. HgCl2 (Sublimat) wurde früher als Desinfektionsmittel in Krankenhäusern verwendet. Thiomersal ist eine organische Quecksilberverbindung, die in sehr geringen Konzentrationen als Bakterizid zur Konservierung von Impfstoffen verwendet wird.
Die konventionelle Landwirtschaft verwendet Quecksilberverbindungen als Beizmittel für Saatgut. In Deutschland wurde die Verwendung von Quecksilber hierfür 1984 verboten.
Heilkunde
Im ausgehenden 19. Jahrhundert hielt man Quecksilber für ein geeignetes Medikament gegen Frauenleiden, weswegen es zum Teil in toxischen Mengen verabreicht wurde. Das Wort hat allerdings nichts mit Quacksalber zu tun, auch wenn der Klang dies nahe legt. (Quacksalber kommt vielmehr aus dem Niederländischen:kwakzalver, wobei kvakken soviel wie "schwatzenv oder "prahlen" bedeutet).
Bis zum Anfang des 20. Jahrhunderts war Quecksilbersalbe ein weit verbreitetes Mittel zur Behandlung der Syphilis.Dazu wurde das Quecksilber in der Regel auf die Haut aufgetragen oder gelegentlich sogar inhaliert, wobei es in vielen Fällen zu Vergiftungserscheinungen kam. Syphilis galt als Volksseuche und Anspielungen auf die Symptome der Syphilis sowie der damit einhergehenden Quecksilbervergiftung finden sich in vielen literarischen Werken der damaligen Zeit.
Metallisches Quecksilber diente im gleichen Zeitraum zur Behandlung von Darmverschlüssen. Der Patient nahm dazu oral mehrere Kilogramm metallisches Quecksilber auf, um das Hindernis im Darm zu überwinden. Wenn er die Behandlung überlebte, verließ das Metall seinen Körper auf natürlichem Wege ohne weitere Vergiftungserscheinungen.
Elektrolyse
Quecksilber spielt eine große Rolle bei der Herstellung von Natronlauge und Chlor nach dem Amalgamverfahren. Während der Elektrolyse wird das reduzierte Natriummetall als Amalgam, einer Natrium-Quecksilber-Legierung, in eine separate Zelle, den Zersetzer, überführt, um die Bildung des explosiven Chlorknallgases und des unerwünschten Natriummonooxochlorates (Natriumhypochlorit) in der Elektrolysezelle zu verhindern.
Goldwäsche
Bei der Goldwäsche wird Quecksilber verwendet, um den feinen Goldstaub zu lösen, wodurch Goldamalgam entsteht. Da Quecksilber schon bei niedrigen Temperaturen flüssig wird, bildet es Legierungen, die besonders leicht schmelzen. Beim Waschen und bei anschließendem Glühen zur Rückgewinnung reinen Goldes gelangt das Quecksilber in die Umgebung. Dies ist der Hauptgrund für die hohe Umweltverschmutzung bei dieser Art der Goldgewinnung.
Mit dieser Methode ist auch ein Vergolden von Kupferblechen möglich, was zum Beispiel bei den Kuppeln der Isaakskathedrale in Sankt Petersburg im 19. Jahrhundert angewendet wurde.
Früher wurde unter anderem im Harz> auf diese Weise auch Silber gewonnen.
Kunst
Im Grabmal des ersten chinesischen Kaisers soll es Flüsse aus Quecksilber gegeben haben. In der Umgebung hat man wissenschaftlich den Boden untersucht und dabei einen unnatürlich hohen Quecksilbergehalt festgestellt. Dieser allein ist aber noch kein Beleg für die Richtigkeit der Legende.
Der amerikanische Künstler Alexander Calder baute 1937 einen Quecksilber-Springbrunnen zum Gedenken an die Todesopfer des Quecksilberabbaus. Um das Jahr 1000 gab es in den Palästen der Kalifen von Córdoba (Medina az-Zahra), Kairo und Bagdad mit Quecksilber gefüllte Becken, die für das Spiel mit Lichtwirkungen genutzt wurden, außerdem in großen Porphyrmuscheln angelegte Quecksilberteiche (für Kairo sind 50 Ellen im Quadrat, also ca. 26 m × 26 m überliefert).
Sonstige Anwendungen
- Verwendung findet das Metall in Knopfzellen und Batterien. Mittlerweile gibt es jedoch nur noch einen Produzenten in Taiwan; der Import in die EU ist nicht mehr zulässig.

- Früher wurde es auch in manchen Röhren der Elektronik wie Quecksilberdampfgleichrichtern, Ignitrons, Excitrons, und Thyratrons verwendet.
- In manchen Ländern werden oder wurden quecksilber-organische Verbindungen zum Beizen von Saatgut verwendet. Dabei kam es im Irak 1971-1972 zu Massenvergiftungen infolge des Verzehrs von Saatgut.
- In der Astronomie wird Quecksilber zum Bau relativ preisgünstiger Teleskope mit großer Spiegelfläche verwendet: Quecksilber wird in einen tellerförmigen, luftgelagerten Spiegelträger gefüllt, der dann in Rotation versetzt wird. Durch die Drehung verteilt sich das Quecksilber auf der gesamten Spiegelträgerfläche in dünner Schicht und bildet einen nahezu perfekten parabolischen Spiegel. Ein Nachteil dieser Teleskope ist, dass sie nur senkrecht nach oben schauen können, weil sonst das Quecksilber ausläuft.
- Die Eigenschaft von Quecksilber, sich wie eine nichtbenetzende Flüssigkeit zu verhalten (Ausnahmen: Amalgambildner wie Kupfer, Silber, Gold, Aluminium), ist Grundlage für die Quecksilberporosimetrie. Hierbei wird Quecksilber unter Druck (0 bis 4000 bar) in Poren unterschiedlicher Größe gedrückt. Über den aufgewendeten Druck und die dabei benötigte Quecksilbermenge können Aussagen über die Beschaffenheit, Form, Verteilung und Größe von Poren und Hohlräumen gemacht werden. Anwendung findet diese Methode unter anderem in der Mineralogie, Pharmazie und den Keramik-Wissenschaften.
- Früher wurden Quecksilbersalze von Hutmachern verwendet und insbesondere bei der Herstellung der im 18. Jahrhundert sehr modischen Filzhüte aus Biberfellen verwendet. Der englische Ausdruck mad as a hatter ("verrückt wie ein Hutmacher") geht vermutlich auf die Anwendung zurück. Er wurde auch durch die Figur des verrückten Hutmachers in Lewis Carrolls Alice im Wunderland populär.
- Quecksilber wurde in der Vergangenheit neben Wasser als Arbeitsmittel in Dampfkraftwerken verwendet. Der Dampf des Metalles erreichte dabei eine Temperatur von 500 °C bei einem Druck von 10 bar. Trotz seiner thermodynamischen Vorteile setzte sich das Verfahren wegen der Giftigkeit des Metalles nicht durch.
- Quecksilber findet (bzw. fand vor allem in der Vergangenheit) auch Verwendung als Arbeitsmittel in Diffusionspumpen zur Erzeugung von ölfreiem Hochvakuum.
- Quecksilberdampf diente zur Entwicklung des Bildes bei der Daguerreotypie, dem ersten praktikablen Fotografie-Verfahren. Das dabei entstehende Foto bestand aus einem Quecksilber-Niederschlag auf einer versilberten Kupferplatte.
Laut Pressemitteilung vom 15. Januar 2009 entschied das Umweltministerium in Schweden, den Gebrauch von Quecksilber generell zu verbieten. Das Verbot bedeutet, dass der Gebrauch von Amalgam in Zahnfüllungen eingestellt wird und dass quecksilberhaltige Produkte nicht mehr in Schweden vermarktet werden dürfen. Andreas Carlgren, der schwedische Umweltminister, sagte: "Das Verbot ist ein starkes Signal für andere Länder und der Beitrag Schwedens zu den Zielen von EU und UN, Gebrauch und Emission von Quecksilber zu reduzieren." Die neuen Regelungen traten am 1. Juni 2009 in Kraft.
Analytik
Klassische, anorganische Nachweisreaktionen
Amalgamprobe

Quecksilbersalze können mit Hilfe der Amalgamprobe durchgeführt werden. Die salzsaure Lösung wird auf ein Kupferblech gegeben und es bleibt ein fester, silbriger Amalgamfleck zurück. Silberionen können den Nachweis stören und werden daher als AgCl gefällt.

Glührohrprobe
Ein weiterer Nachweis für Quecksilber ist die Glührohrprobe. Dabei wird die zu analysierende Substanz mit etwa der gleichen Menge Natriumcarbonat (Soda) vermengt und im Abzug geglüht. Elementares Quecksilber scheidet sich als metallischer Spiegel an der Reagenzglaswand ab.
Qualitativer Nachweis im Trennungsgang
Im qualitativen Trennungsgang kann Quecksilber sowohl in der HCl-Gruppe als auch in der H2S-Gruppe nachgewiesen werden. Nach Zugabe von HCl bildet sich Kalomel, Hg2Cl2, welches nach Zugabe von Ammoniaklösung zu fein verteiltem Quecksilber und Quecksilber(II)-Amidochlorid reagiert. Nach Einleiten von H2S fällt zweiwertiges Quecksilber in Form von schwarzem Zinnober, HgS, aus und kann mit Hilfe der Amalgamprobe nachgewiesen werden.
Instrumentelle Analytik des Quecksilbers
Für die Spurenanalytik des Quecksilbers und seiner Organoderivate stehen eine Reihe von Methoden zur Verfügung. Allerdings werden in der Literatur laufend neue bzw. verbesserte Verfahren vorgestellt. Ein nicht zu unterschätzendes Problem ist die Probenaufarbeitung.
Atomabsorptionsspektrometrie (AAS)
Unter den verschiedenen Techniken der AAS liefern die Quarzrohr- und die Graphitrohrtechnik die besten Ergebnisse für anorganische und metallorganische Quecksilberverbindungen. Dabei wird eine Quarzküvette elektrisch auf über 900 °C erhitzt und die Probe dabei atomisiert. Anschließend wird die Absorption bei 253,7 nm gemessen. Als Beispiel sei eine Nachweisgrenze für CH3HgCl von 100 μg/L genannt. Eine weitere beliebte Technik zum Nachweis von elementarem Quecksilber oder Quecksilberorganylen ist die Kaltdampferzeugung in Verbindung mit der AAS. Bei sehr geringen Konzentrationen werden die volatilen Analytspezies zunächst unter Bildung von Amalgamen auf Gold- oder Silberoberflächen, welche in einer Graphitküvette platziert wurden, angereichert. Anschließend wird bei 1400 °C atomisiert und die Absorption gemessen. Auf diesem Wege wurde eine Nachweisgrenze von 0,03 ng erreicht.
Atomemissionsspektrometrie (AES)
In der AES haben sich das mikrowelleninduzierte Plasma (MIP) und das induktiv gekoppelte Plasma (ICP) zur Atomisierung bewährt. Die Detektion findet auch bei dieser Methode bei 253,65 nm und 247,85 nm statt. Mit Hilfe der MIP-AES wurden absolute Nachweisgrenzen von 4,4 ng/g Probe gefunden. Die ICP-AES weist eine Nachweisgrenze von 20-50 ng/mL auf.
Massenspektrometrie (MS)
Quecksilber weist insgesamt sieben stabile Isotope unterschiedlicher Häufigkeit auf. Für die Massenspektrometrie sind jedoch häufig nur 201Hg (13,22 %) und 202Hg (29,80 %) relevant. Mit Hilfe der ICP-MS können anorganische Quecksilberverbindungen und Quecksilberorganyle wie Methylquecksilber, CH3Hg, mit Nachweisgrenzen von bis zu 2,6 ng/g bestimmt werden.
Neutronenaktivierungsanalyse (NAA)
Die NAA basiert auf der Kernreaktion AHg(n,γ)A+1Hg (Bestrahlung von Quecksilber mit Neutronen). Dadurch entstehen radioaktive Quecksilbernuklide. Die Intensität resultierenden charakteristischen Gammastrahlung wird mit einem hochreinen Germaniumdetektor bestimmt. Sie ist proportional der Anzahl an vorhandenen aktivierten Kernen und es können durch interne Kalibrierung quantitative Aussagen getroffen werden. Häufig wird 197mHg mit einer Halbwertszeit von 2,7 Tagen bei 77,3 keV detektiert.
Voltammetrie
Für die elektrochemische Bestimmung von Hg-Spuren eignet sich am besten die anodische Stripping-Voltammetrie (ASV). Dabei geht der voltammetrischen Messung eine reduktive Anreicherungsperiode auf der Gold-Messelektrode voraus. Es folgt die eigentliche Bestimmung durch Messung des Oxidationsstroms beim Scannen eines Spannungsfensters von 0 V bis 600 mV. Die Höhe des Oxidationspeaks bei 500 mV korreliert mit der Menge an vorhandenem Quecksilber. Es wurden Nachweisgrenzen von 12 pM Quecksilber im Meerwasser nach 2-minütiger Anreicherungszeit erzielt. Daneben kommt die Invers-Voltammetrie an Gold-, Platin- oder Kohleelektroden in Frage.
Automatisierte Analytik
Für die Routineanalytik von Quecksilber gibt es mittlerweile automatisierte Analysatoren. Sie beruhen üblicherweise auf dem Prinzip der thermischen Zersetzung, gefolgt von einer Amalgamierung und anschließender Messung der Atomabsorption (siehe AAS). Mit derartigen Analysengeräten können feste und flüssige Proben innerhalb von wenigen Minuten auf ihren Quecksilbergehalt untersucht werden. Diese kommerziell erhältlichen Geräte sind sehr empfindlich und genügen den Anforderungen von nationalen Qualitäts-sicherungsstandards wie der US-EPA-Methode 7473 und der ASTM-Methode D-6722-01.
Umweltemissionen
Quecksilber wird in großen Mengen durch menschliche Aktivitäten freigesetzt. Es wird geschätzt, dass jährlich etwa 2.200 Tonnen als gasförmiges Quecksilber in die Atmosphäre abgegeben werden, zudem noch erhebliche Mengen in Böden und Gewässer. Die größte Emissionsquelle ist das Verbrennen von Biomasse, vornehmlich die Brandrodung von Regenwäldern. Der anhaltende Ausbau von Kohlekraftwerken in China wird jedoch dazu führen, dass sich in Zukunft die Kohleverbrennung zum größten Emittenten entwickelt. In Stein- und Braunkohle tritt Quecksilber zwar nur in Spuren auf, die hohe Menge der weltweiten verbrannten Kohle führt aber zu erheblichen Freisetzungsraten. Weitere bedeutsame Quellen sind die Chlorproduktion, Zementwerke und die kleingewerbliche Goldgewinnung (Artisanal Small Scale Mining). Aufgrund der bekannten Gefahren freigesetzten Quecksilbers wird derzeit auf der Ebene des UN-Umweltprogramms (UNEP) geplant, ein eigenes internationales Abkommen mit dem Ziel der weltweiten Senkung der Emissionen zu verabschieden.
In Norwegen sind quecksilberhaltige Produkte seit 2008, in Schweden seit 2009 verboten.
Gesundheitsschäden durch Quecksilber
Quecksilber ist ein giftiges Schwermetall, das bereits bei Zimmertemperatur verdunstet. Bei der Aufnahme über den Verdauungstrakt ist reines metallisches Quecksilber vergleichsweise ungefährlich, eingeatmete Dämpfe wirken aber stark toxisch. Besonders toxisch sind vor allem die organischen Verbindungen des Quecksilbers, wenn sie mit der Nahrung aufgenommen werden. Je nach Aufnahme sind sowohl eine akute als auch eine chronische Vergiftung möglich. Als Beispiel kann der Fall des englischen Schiffes Triumph im Jahre 1810 dienen, auf dem sich mehr als 200 Menschen vergifteten, als ein Fass mit Quecksilber auslief.
In jüngerer Zeit (2007) sind ayurvedische Mittel mit hohen Quecksilbergehalten aufgefallen.
Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 25.02. 2023