
Cadmium
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Einstufung nach REACH | besonders besorgniserregend: krebserzeugend (CM), ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich | |||||||||
Cadmium (selten auch Kadmium; griechisch καδμία kadmía, lateinisch cadmea; ‚oxidische oder carbonathaltige Zinkerde‘) ist ein chemisches Element mit dem Elementsymbol Cd und der Ordnungszahl 48. Es wird meist zu den Übergangsmetallen gezählt, obwohl es eine abgeschlossene d-Schale besitzt und damit eher den Hauptgruppenelementen, vor allem den Erdalkalimetallen ähnelt. Im Periodensystem steht es in der 5. Periode sowie der 2. Nebengruppe (Gruppe 12) oder Zinkgruppe.
Geschichte
1817 entdeckten Friedrich Stromeyer und Carl Samuel Hermann unabhängig voneinander Cadmium in verunreinigtem Zinkcarbonat. Stromeyer bemerkte, dass sich verunreinigtes Zinkcarbonat beim Erhitzen verfärbte – ein Verhalten, das reines Zinkcarbonat nicht zeigte. Annähernd 100 Jahre lang wurde das Metall nur in Deutschland gewonnen.
Plinius der Ältere berichtet in seiner um das Jahr 77 entstandenen Naturkunde Naturalis historia von Galmeifunden in Germanien: “cadmea […] ferunt nuper etiam in Germania provincia repertum” (deutsch: „kürzlich wurde in der Provinz Germanien Galmei gefunden“). Die Bezeichnung Cadmium wurde schon im Mittelalter verwendet, vermutlich für Zink oder sein Karbonaterz. Wie aus einer von Kaiser Friedrich II. im April 1226 in Ravenna ausgestellten Urkunde hervorgeht, räumt dieser dem Benediktiner-Kloster St. Paul im Lavanttal das Recht ein “ut Cadmiae tam argentj quam plumbi et ferri, que in territorio ipsius monasteri de cetero inveniri contigerint, ad opus suum” (deutsch: „dass das Zink, sowie Silber, als auch Blei und Eisen, welches auf dem Gebiet des Klosters gefunden wird, für dessen Zwecke verwendet wird“).
Trotz der Giftigkeit von Cadmium und seinen Verbindungen verzeichnete der British Pharmaceutical Codex von 1907 Cadmiumjodid als Mittel zur Behandlung von geschwollenen Gelenken (enlarged joints), skrofulösen Drüsen (scrofulous glands) und Frostbeulen (chilblains).
1907 definierte die Internationale Astronomische Union ein Ångström als das 1/6438,4696-fache der Wellenlänge einer roten Spektrallinie des Cadmiums in trockener Luft mit einem Kohlendioxidgehalt von 0,03 % bei einer Temperatur von 15 °C und einem Druck von 1 atm. Die General Conference on Weights and Measures akzeptierte im Jahr 1960 die 1.553.164,13-fache Wellenlänge einer roten Spektrallinie des Cadmiums als Sekundärdefinition eines Meters.
1942 benutzte Enrico Fermi Cadmiumbleche im weltweit ersten Kernreaktor. Die Bleche konnten in den Reaktor hinein- und hinausgeschoben werden, um die Kettenreaktion steuern zu können. Cadmium kann moderierte Spaltneutronen einfangen und so die Kritikalität des Reaktors beeinflussen.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Cadmium, Cd, 48 |
| Serie | Übergangsmetalle |
| Gruppe, Periode, Block | 12, 5, d |
| Aussehen | silbrig grau metallisch |
| CAS-Nummer | 7440-43-9 |
| ATC-Code |
D11AC02 |
| Massenanteil an der Erdhülle | 0,3 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Kristallstruktur | hexagonal |
| Dichte | 8,65 g/cm3 (25 °C) |
| Mohshärte | 2,0 |
| Magnetismus | diamagnetisch (Χm = −1,9 · 10−5) |
| Schmelzpunkt | 594,22 K (321,07 °C) |
| Siedepunkt | 1038 K (765 °C) |
| Molares Volumen | 13,00 · 10−6 m3·mol−1 |
| Verdampfungswärme | 100 kJ/mol |
| Schmelzwärme | 6,2 kJ·mol−1 |
| Schallgeschwindigkeit | 2310 m·s−1 bei 293,15 K |
| Austrittsarbeit | 4,2 eV |
| Elektrische Leitfähigkeit | 14,3 · 106 A·V−1·m−1 |
| Wärmeleitfähigkeit | 97 W·m−1·K−1 |
| Chemisch | |
| Oxidationszustände | 2 |
| Oxide (Basizität) | CdO (leicht basisch) |
| Normalpotential | −0,403 V (Cd2+ + 2 e− → Cd) |
| Elektronegativität | 1,69 (Pauling-Skala) |
Vorkommen
Cadmium ist ein sehr seltenes Element. Sein Anteil an der Erdkruste beträgt nur etwa 3 · 10−5 %. Gediegen, das heißt in elementarer Form, kommt Cadmium äußerst selten vor. Bisher sind nur fünf Fundorte in drei Ländern bekannt: Der Fluss Khann'ya im Wiljui-Becken, das Jana-Flussbecken nahe Werchojansk und die Billeekh Intrusion in der russischen Republik Sacha (Jakutien, Ostsibirien); die Goldstrike-Gruben bei Lynn im Eureka County des US-Bundesstaates Nevada sowie das Burabaiskii-Massiv im Gebiet Aqumola von Kasachstan.
Als cadmiumhaltige Erze sind vor allem die Cadmiumblende Greenockit (CdS) mit bis zu 77,81 % Cd und der Cadmiumspat Otavit (CdCO3) mit bis zu 65,20 % Cd bekannt, die allerdings zu selten für den kommerziellen Abbau sind. Beide sind fast immer mit verschiedenen Zinkerzen wie Sphalerit (ZnS) und Smithsonit (ZnCO3) vergesellschaftet.
Insgesamt sind bisher (Stand 2018) etwas mehr als 20 Cadmiumminerale bekannt. Das sehr seltene Cadmiumoxid Monteponit hat den höchsten Cd-Gehalt mit bis zu 87,54 %. Weitere Minerale sind unter anderem Hawleyit (77,81 % Cd), Cadmoselit (58,74 % Cd) und Drobecit (IMA 2002-034, 40,07 % Cd).
Cadmium als Mineral
Natürlich vorkommendes Cadmium in seiner elementaren Form wurde erstmals 1979 durch B. V. Oleinikov, A. V. Okrugin und N. V. Leskova beschrieben. und von der International Mineralogical Association (IMA) als eigenständige Mineralart anerkannt (Interne Eingangs-Nr. der IMA: 1980-086a).
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Cadmium unter der System-Nr. 1.AB.05 (Elemente – Metalle und intermetallische Verbindungen – Zink-Messing-Familie – Zink-Gruppe) eingeordnet. In der veralteten 8. Auflage der Strunz’schen Mineralsystematik ist Cadmium dagegen noch nicht aufgeführt. Nur im zuletzt 2018 aktualisierten „Lapis-Mineralienverzeichnis“, das sich aus Rücksicht auf private Sammler und institutionelle Sammlungen noch an dieser Form der System-Nummerierung orientiert, erhielt das Mineral die System- und Mineral-Nr. I/A.4-40. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.05.02.
Gewinnung und Darstellung
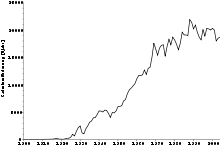
Cadmium wird ausschließlich als Nebenprodukt bei der Zinkverhüttung, in kleinem Umfang auch bei der Blei- und Kupferverhüttung gewonnen. Kleinere Mengen fallen auch beim Recycling von Eisen und Stahl an.
Die Gewinnung von Cadmium hängt vom Verfahren ab, wie das Zink gewonnen wird. Bei der trockenen Zinkgewinnung wird zunächst das Cadmium mit dem Zink reduziert. Da Cadmium einen niedrigeren Siedepunkt als Zink besitzt, verdampft es leichter. Dadurch verdampft ein Cadmium-Zink-Gemisch aus dem Reduktionsgefäß und reagiert an anderer Stelle mit Sauerstoff zu Cadmium- und Zinkoxid. Anschließend wird dieses Gemisch in einem Destillationsgefäß mit Koks vermischt und das Cadmium vom Zink abdestilliert. Durch fraktionierte Destillation lassen sich höhere Reinheiten an Cadmium erreichen.
Bei der nassen Zinkgewinnung werden die gelösten Cadmiumionen mit Zinkstaub reduziert und ausgefällt. Das dabei entstehende Cadmium wird mit Sauerstoff zu Cadmiumoxid oxidiert und in Schwefelsäure gelöst. Aus der so entstandenen Cadmiumsulfat-Lösung wird durch Elektrolyse mit Aluminiumanoden und Bleikathoden besonders reines Elektrolyt-Cadmium gewonnen.
Eigenschaften

Physikalische Eigenschaften
Cadmium ist ein silbrig glänzendes Metall mit einer Dichte von 8,65 g/cm3. Es ist weich (Mohshärte 2), plastisch verformbar und lässt sich ebenso mit dem Messer anschneiden wie zu Drähten ziehen und zu Blättchen aushämmern.
Cadmium erstarrt ausschließlich im hexagonalen Kristallsystem in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194). Die Gitterparameter von reinem Cadmium betragen a = 0,2979 nm (entspricht 2,98 Å) und c = 0,5617 nm (entspricht 5,62 Å) bei 2 Formeleinheiten pro Elementarzelle.
Ähnlich wie bei Zinn treten beim Verbiegen von Cadmium mittlerer Reinheit typische Geräusche auf (bei Zinn Zinngeschrei genannt). Poliertes Cadmium verliert an Luft nach einigen Tagen seinen Glanz, auch wenn es korrosionsbeständiger ist als Zink. In kohlensäurehaltiger Luft bildet es einen grauweißen, kohlendioxidhaltigen Überzug. Stark erhitzt verbrennt es mit rötlicher bis gelber Flamme zu bräunlich dampfendem Cadmiumoxid CdO.
CdO wurde wegen seiner hohen Toxizität im Zweiten Weltkrieg von den USA auf seine Verwendbarkeit als chemischer Kampfstoff untersucht.
Chemische Eigenschaften
In chemischen Verbindungen liegt es meist zweiwertig vor. Chemisch gleicht es dem Zink, es neigt aber eher zur Bildung von Komplex-Verbindungen mit der Koordinationszahl 4. An der Luft bildet Cadmium durch die Oxidation eine Verdunklung der Oberfläche. In alkalischem Milieu ist die Oberfläche unlöslich, in Schwefelsäure und Salzsäure schwer und in Salpetersäure gut löslich.
Verwendung
Wegen der hohen Toxizität von Cadmium nimmt dessen Bedeutung ab. Seit Dezember 2011 ist es in Schmuck, Legierungen zum Löten und in PVC in der Europäischen Union verboten. Cadmium wird bzw. wurde eingesetzt:
- als Korrosionsschutz für Eisenwerkstoffe (Kadmierung)
- als Oberflächenüberzug für Aluminiumwerkstoffe in der Wehrtechnik (z.B. bei Raketenwerfern)
- für Nickel-Cadmium-Akkumulatoren
- für gelbe bis tiefrote Farbpigmente aus Cadmiumsulfid und Cadmiumselenid für Lacke und Kunststoffe (mittlerweile geringe Praxisbedeutung wegen möglicher Gesundheitsgefährdung, vor allem bei der Verbrennung entsprechender Artikel)
- als Legierungsmetall in niedrigschmelzenden Legierungen, zum Beispiel Lagerwerkstoffe oder Woodsches Metall
- früher als Schmiermittel in Scheibenbremsen
- als Bestandteil von Lötwerkstoffen (Lötzinn), auch für Hartlote
- zur Herstellung von Halbleitern
- Cadmiumoxid als Leuchtstoff in Schwarz-Weiß-Fernsehröhren sowie Zusatz in Blau- und Grünphosphor von Farbröhren
- Cadmiumoxid als Beimischung zu Silber in Schaltkontakten
- als Abschirmmaterial gegen thermische Neutronen und für Regelstäbe in der Nukleartechnik aufgrund des besonders hohen Wirkungsquerschnitts des Isotops 113 für den Neutroneneinfang
- als Quelle von energiereicher Gammastrahlung (rund 7 MeV) aus thermischen Neutronen zur späteren Erzeugung von Positronen durch Paarerzeugung
- Cadmiumsulfid in Belichtungsmessern, deren spektrale Empfindlichkeit der des menschlichen Auges gleicht
- Cadmiumtellurid als infrarotempfindlicher Sensor für Kameras (focal plane arrays)
- in Dünnschicht-Solarzellen als Cadmiumtellurid oder Cadmiumsulfid zur Stromerzeugung
- Cd-Stearat als Stabilisator in Kunststoffen beispielsweise in PVC (unempfindlich gegen Licht, allerdings mittlerweile von geringer Praxisbedeutung wegen möglicher Gesundheitsgefährdungen)
- früher in den Weston-Normalelementen zur Festlegung der Maßeinheit der elektrischen Spannung, 1 Volt
- Cadmium-Bismut-Legierungen für Schmelzsicherungen
- Silber-Cadmium-Legierungen als Desoxidationsmittel in der Herstellung von Sterling-Silber
- bei Schmuckwaren: goldgrüne Gold-Cadmium-Legierungen
- Cadmium-Lampe
- Helium-Cadmium-Laser
- Cadmium-Ionen zur Blockade spannungsaktivierter Calciumkanäle in der Elektrophysiologie
- zum Färben von Glas in Gelb, Orange und Rot durch Zusatz von Cadmiumsulfid, -selenid und -tellurid oder Mischungen davon.
Die Cadmium-Chalkogenide Cadmiumsulfid (gelb), Cadmiumselenid (rot) und Cadmiumtellurid (schwarz) sind wichtige II-VI-Halbleiter. Sie werden beispielsweise nanopartikulär als Quantenpunkte (engl. Quantum Dots) hergestellt und u.a. in der Biochemie in-vitro eingesetzt.
Nachweis
Als Vorprobe für Cadmium kann die sogenannte Glühröhrchenprobe dienen. Hierzu wird etwas Ursubstanz in einem hochschmelzenden Glühröhrchen erhitzt und das entstehende Sulfid-Oxid-Gemisch mit Natriumoxalat zu den Metallen reduziert. Als leichtflüchtiger Bestandteil verdampft Cadmium und scheidet sich als Metallspiegel am oberen Teil des Röhrchens ab.
Durch anschließende Zugabe von Schwefel und erneutem Glühen bildet sich aus dem Metallspiegel und Schwefeldampf Cadmiumsulfid, welches in der Hitze rot und bei Raumtemperatur gelb ist. Dieser Farbwechsel lässt sich einige Male wiederholen.
Als Nachweisreaktion für Cadmium-Kationen gilt die Ausfällung mit Sulfid-Lösung oder Schwefelwasserstoff-Wasser als gelbes Cadmiumsulfid. Andere Schwermetallionen stören diesen Nachweis, so dass zuvor ein Kationentrenngang durchzuführen ist.
Zur quantitativen Bestimmung von Cadmiumspuren bietet sich die Polarographie an. Cadmium(II)-Ionen geben in 1 M KCl eine Stufe bei −0,64 V (gegen SCE). Im Ultraspurenbereich kann die Inversvoltammetrie an Quecksilberelektroden eingesetzt werden. Sehr empfindlich ist auch die Graphitrohr-AAS von Cadmium. Hierbei können noch 0,003 µg/l nachgewiesen werden. Das relativ leicht flüchtige Element verträgt dabei keine hohe Pyrolysetemperatur. Ein Matrixmodifizierer wie Palladium-Magnesiumnitrat kann Abhilfe schaffen.
Sicherheitshinweise
Cadmium ist als sehr giftig und seine Verbindungen von gesundheitsschädlich (wie Cadmiumtellurid) über giftig (z.B. Cadmiumsulfid) bis sehr giftig (so bei Cadmiumoxid) eingestuft; außerdem besteht begründeter Verdacht auf krebsauslösende Wirkung beim Menschen. Eingeatmeter cadmiumhaltiger Staub führt zu Schäden an Lunge, Leber und Niere.
In Arbeitsbereichen, in denen mit erhitzten Cadmiumverbindungen gearbeitet wird (Lötplätze und Cadmierbäder), ist für eine gute Durchlüftung oder Absaugung zu sorgen. Gemäß Chemikalienverbotsverordnung darf der Cadmiumgehalt in Kunststoffen 0,01 Gewichtsprozent (100 mg/kg) nicht überschreiten. Dieser Grenzwert gilt in der ganzen Europäischen Union.
Seit Dezember 2011 gilt ein strengeres Verbot für Cadmium in Kunststoffen, Farben, Stabilisierungsmitteln sowie bei bestimmter Metallverarbeitung per REACH-Verordnung, Eintrag 23 in Anhang XVII. Bisher war in Silberhartlot typisch 10 % bis 25 % Cadmium enthalten, in Schmuck für Kinder bis zu 30 %, in PVC 0,2 %. Mit dem 10. Dezember 2011 wurde das Verbot auf cadmiumhaltige Lote beim Löten und der Erzeugung und das Inverkehrbringen cadmiumhaltigen Schmucks ausgedehnt. Zudem wurden auch alle PVC-haltigen Erzeugnisse mit Ausnahme des PVC-Recyclings eingebunden. Mit der Verordnung (EU) 2016/217 vom 16. Februar 2016 wurde Cadmium in gewissen Anstrichfarben und Lacken in den Eintrag 23 in Anhang XVII der REACH-Verordnung aufgenommen. Außerdem wurde der Cadmium-Gehalt in bestimmten Anstrichfarben und Lacken mit Zinkgehalt oder damit versehenen Erzeugnissen beschränkt. Es gibt noch Ausnahmen, etwa wegen der hohen Leistungsdichte für Ni-Cd-Akkus in Schnurloselektrogeräten.
Toxikologie
Cadmium ist in der chemischen Industrie ein unvermeidbares Nebenprodukt der Zink-, Blei- und Kupfergewinnung. Auch in Düngern und Pestiziden ist Cadmium zu finden.
Aufnahme und Gefahren
Die Weltgesundheitsorganisation hat ihre Aussage zur tolerierbaren Aufnahmemenge für Cadmium in den letzten Jahren mehrfach nach unten angepasst, zuletzt 2013 auf eine tolerierbare monatliche Aufnahmemenge (TMI) von 25 µg je Kilogramm Körpergewicht. Die Europäische Behörde für Lebensmittelsicherheit hat 2009 einen wiederum deutlich niedrigeren Wert von 2,5 µg je Kilogramm Körpergewicht tolerierbare wöchentlich Aufnahmemenge (TWI) ausgegeben.
Cadmium wird vom Menschen hauptsächlich durch die Nahrung aufgenommen. Zu den cadmiumreichen Nahrungsmitteln zählen: Leber, Pilze, Muscheln und andere Schalentiere, Kakaopulver und getrockneter Seetang. Darüber hinaus enthalten Leinsamen viel Cadmium, weshalb empfohlen wird, täglich nicht mehr als 20 g Leinsamen zu sich zu nehmen. Zudem kommt es seit der Einführung von Kunstdüngern zu einer Anreicherung von Cadmium auf landwirtschaftlichen Flächen und somit in nahezu allen Lebensmitteln. Die Ressourcen von Phosphaten sind begrenzt, und die meisten Vorkommen sind belastet mit Cadmium oder radioaktiven Schwermetallen. Der Cadmiumgehalt der Phosphatlagerstätten ist sehr unterschiedlich. Viele Industrieländer haben bereits einen Grenzwert für Cadmium in Düngemitteln eingeführt. In Österreich ist die Cadmiumkonzentration auf 75 mg/kg P2O5 begrenzt. Auch Tabakrauch transportiert relativ große Cadmiummengen in die Lungen, von wo aus es sich mit dem Blut im Körper verteilt.
Besonders Personen, die in Fabriken mit hohem Cadmiumausstoß arbeiten, sind erhöhten Gefahren ausgesetzt. Aber auch von wilden Müllplätzen und Metallwerken gehen Gefahren aus. Das Einatmen von Cadmium kann die Lungen ernsthaft schädigen und sogar zum Tod führen. Unfälle in der Industrie – wie in der chinesischen Provinz Guangdong – und jahrzehntelange Emissionen – wie im Falle der Itai-Itai-Krankheit (bei Menschen) und der >Gressenicher Krankheit (bei Weidevieh) – machen die realen Gefahren deutlich.
Schädigungen im Menschen
Cadmium kann sich industrie- oder umweltbedingt allmählich im Körper anreichern und eine schwer erkennbare chronische Vergiftung hervorrufen.
Cadmium wird aus der Nahrung zu ungefähr 5 % im Darm resorbiert. Bei Eisen- und Calciummangel steigt die Resorptionsrate, was annehmen lässt, dass alle drei Metalle denselben Transportweg nutzen. Cadmium stimuliert zunächst in der Leber die Synthese von Metallothioneinen, mit denen es einen Komplex bildet und über den Blutkreislauf zu den Nierenglomeruli transportiert, dort filtriert und aus den Nierentubuli wieder aufgenommen wird. In den Tubuluszellen wird der Metallothionein-Cadmium-Komplex metabolisiert und Cd freigesetzt. Cd aktiviert hier wiederum eine vermehrte Metallthionsynthese, wodurch noch mehr Cadmium gebunden wird. Durch die Akkumulation in den Nieren kommt es zu Schädigungen dieses Organs mit der Folge einer Proteinurie. Durch diese Proteinbindung wird Cadmium nur extrem langsam ausgeschieden, die Halbwertszeit für den Verbleib im Körper beträgt bis zu 30 Jahren. Daher steigt der Cadmiumgehalt von Geburt an und fällt erst wieder bei einem Alter von 50–60 Jahren.
Cadmium schädigt auch die Knochen, da es letztendlich zur Mobilisierung des Calciums führt. Cd konkurriert im Darm mit dem Calcium um die Bindungsstellen am Ca-bindenden Protein in der Darmmukosa. Zusätzlich blockiert Cd die Neusynthese des 1,25-Dihydroxycholecalciferol (Calcitriol) in den Nierentubuluszellen. 1,25-Dihydroxycholecalciferol ist notwendig, um die Synthese des Calciumbindenden Proteins in der Darmmukosazelle zu aktivieren. In summa bewirkt Cadmium eine verminderte Rückresorption des Calciums in Darm und Niere sowie die erhöhte Ausscheidung mit dem Harn mit der Folge einer Calciumfreisetzung aus den Knochen und damit dem Abbau derselbigen.
Bei einer akuten Cadmiumvergiftung kann die biliäre Ausscheidung durch Gabe von Penicillamin oder Dimercaprol unterstützt werden. Eine effektive, darüber hinausgehende Therapie einer akuten Cadmiumvergiftung ist nicht bekannt.
Symptome
- Durchfall, Magenschmerzen und heftiges Erbrechen
- Nierenschädigung
- Knochenbrüche
- Schäden am Zentralnervensystem
- Schäden am Immunsystem
- Störungen in der Fortpflanzung und eventuell sogar Unfruchtbarkeit
- Psychische Störungen
- Mögliche DNA-Schäden und Krebsentstehung
- Verlust des Geruchssinns
Verbindungen
Oxide und Hydroxide
- Cadmiumoxid CdO
- Cadmiumhydroxid Cd(OH)2
Halogenide
- Cadmiumfluorid CdF2
- Cadmiumchlorid CdCl2
- Cadmiumbromid CdBr2
- Cadmiumiodid CdI2
Chalkogenide
- Cadmiumsulfid CdS
- Cadmiumselenid CdSe
- Cadmiumtellurid CdTe


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 06.01. 2026



