Uran(VI)-fluorid
| Sicherheitshinweise | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| MAK | 1 mg/m3 | |||||||||||||||||||
| Radioaktivität | ||||||||||||||||||||
 Radioaktiv | ||||||||||||||||||||
Uran(VI)-fluorid (UF6), meistens Uranhexafluorid genannt, ist eine chemische Verbindung aus den Elementen Uran und Fluor. Es ist ein farbloser, kristalliner Feststoff, der leicht flüchtig, radioaktiv und äußerst giftig ist. Es ist eine sehr aggressive Substanz, die nahezu jeden Stoff und auch jedes biologische Gewebe angreift. Uranhexafluorid ist beständig in trockener Luft, reagiert jedoch sehr heftig mit Wasser. In den meisten Fällen wird es aus Uran(IV)-fluorid (UF4) durch Umsetzung mit elementarem Fluor (F2) gewonnen.
Bei Normaldruck und einer Temperatur von 56,5 °C geht Uranhexafluorid durch Sublimation direkt vom festen in den gasförmigen Zustand über. Es ist die einzige Uranverbindung, die sich leicht in die Gasphase überführen lässt. Aufgrund dieser Eigenschaften hat es seine besondere technische Bedeutung bei der Uran-Anreicherung erhalten. Durch Gasdiffusionsverfahren oder Gasultrazentrifugen erfolgt eine Trennung des für nukleare Anwendungen wichtigen und seltenen Uranisotops 235U vom weitaus häufigeren Uranisotop 238U.
Geschichte
Alfred Ditte beschrieb 1880 die Umsetzung eines grünen Uranoxids (U3O4) mit einem Überschuss an konzentrierter Flusssäure, wobei zum Teil eine gelbe Flüssigkeit entstand, die beim Erhitzen verdampfte und sich in Form gelber transparenter Kristalle niederschlug mit der Formel U2Fl2,4HFl. Er beschrieb ferner ein „Oxyfluorure“ (U2OFl2), das sehr flüchtig ist; beim Kontakt mit Luftsauerstoff zersetzte sich der „weiße Schnee“ zu einem schwarzen Stoff. Diese Ergebnisse wurden 1884 in größerem Zusammenhang erneut publiziert. Diese Angaben sind allerdings als Irrtum anzusehen.
Uranhexafluorid wurde 1909 erstmals von Otto Ruff dargestellt.
Darstellung aus Uran(V)-chlorid und Fluor:
Darstellung aus Uran(V)-chlorid und Fluorwasserstoff (HF). Die Reaktion ist zur Darstellung von reinem UF6 nicht geeignet, da es sich nur schlecht von HF trennen lässt.
Lässt man Uranmetall oder Urancarbid (UC2) mit Fluor (in Gegenwart geringer Mengen von Chlor als Katalysator) zur Reaktion kommen, so ist eine vollständige Umwandlung zu UF6 zu beobachten.
Lange Zeit blieb Uranhexafluorid lediglich für Laborstudien interessant. Erst mit der Entdeckung der Kernspaltung im Jahre 1938 erlangte diese Verbindung größere Bedeutung, da sie die einzige deutlich flüchtige und gleichzeitig stabile Verbindung des Urans ist. Aristid von Grosse fasste 1941 die bisher bekannten Eigenschaften zusammen und beschrieb zudem das chemische Verhalten gegenüber anorganischen und organischen Stoffen sowie in Glasgefäßen in Gegenwart von Verunreinigungen. Dampfdruck und Tripelpunkt wurden von Bernard Weinstock und Ray Crist gemessen. Die Arbeiten wurden am 9. Februar 1942 abgeschlossen. Das 1943 erstellte Manuskript wurde 1947 freigegeben und 1948 veröffentlicht. Isidor Kirshenbaum fasste 1943 die physikalischen Eigenschaften zusammen.
| Strukturformel | |
|---|---|
 | |
| Kristallsystem | |
| Raumgruppe |
Pnma (Nr. 62) |
| Gitterkonstanten |
a = 990,0 pm |
| Allgemeines | |
| Name | Uran(VI)-fluorid |
| Andere Namen | Uranhexafluorid |
| Summenformel | UF6 |
| CAS-Nummer | 7783-81-5 |
| PubChem | 24560 |
| Kurzbeschreibung | farblose Kristalle |
| Eigenschaften | |
| Molare Masse | 351,99 g·mol−1 |
| Aggregatzustand | fest |
| Dichte | 5,09 g/cm3 (20,7 °C) |
| Sublimationspunkt | 56,5 °C |
| Dampfdruck | 153 hPa (25 °C) |
| Löslichkeit | heftige Zersetzung mit Wasser |
| Thermodynamische Eigenschaften | |
| ΔHf0 |
|
Darstellung
Uranhexafluorid kann grundsätzlich aus Uranmetall sowie praktisch allen Uranverbindungen durch Umsetzung mit elementarem Fluor sowie Chlor- und Bromfluoriden dargestellt werden.
Man kann die Bildungsmethoden unterteilen in:
- Darstellung aus Uran(VI)-verbindungen ohne Änderung der Oxidationsstufe, z.B. Umhalogenierung von Uran(VI)-chlorid (UCl6), Fluorierung von Uranylfluorid (UO2F2) sowie die thermische Zersetzung von UOF4, UO2F2 oder von Fluorouranaten(VI).
- Darstellung aus Uran oder Uranverbindungen mit niedrigeren Oxidationsstufen, z.B. die oxidierende Fluorierung von Uranmetall, von Uran(V)-chlorid (UCl5), der verschiedenen Uranoxide, Urancarbide und Uranfluoride.
- Verwendung anderer Fluorierungsmittel wie Interhalogenverbindungen und Edelgasfluoride.
Standardmethode
Die gängige Methode zur Darstellung von Uranhexafluorid ist die Umsetzung von Uran(IV)-fluorid (UF4) mit elementarem Fluor (F2). Bei Temperaturen über 250 °C findet die Reaktion statt und wird meist bei 300 °C durchgeführt; die Reaktion ist endotherm:
Setzt man Fluor mit etwa 50 % Überschuss ein, so verläuft die Reaktion vollständig. Dieser Prozess wird auch technisch genutzt. Das Fluor wird aus dem Anodenprozess der Elektrolyse einer Kaliumfluorid-Fluorwasserstoff-Mischung gewonnen.
In gleicher Weise entstehen Neptuniumhexafluorid (NpF6) bei 500 °C aus Neptuniumtetrafluorid (NpF4) und F2 sowie Plutoniumhexafluorid (PuF6) bei 750 °C aus Plutoniumtetrafluorid (PuF4) und F2.
Mit anderen Fluorverbindungen
Mit Chlortrifluorid (ClF3), Bromtrifluorid (BrF3) und Brompentafluorid (BrF5) reagieren sämtliche Uranoxide zu UF6. Die Reaktivität der Halogenfluoride ist dabei höher als die von elementarem Fluor. UO2 setzt sich mit BrF3 schon bei etwa 50 °C um, die Reaktion mit Fluor läuft dagegen erst bei etwa 400 °C ab. Die Halogenfluoride setzen sich heftig mit Uranmetall um; die Reaktion mit BrF3-Dampf kann zur Explosion führen.
Auch mit Edelgasfluoriden wie z.B. Xenondifluorid (XeF2) wird UF4 bei höherer Temperatur unter Druck oder in flüssigem HF zu UF6 umgesetzt.
Stickstofftrifluorid (NF3) fluoriert Uranmetall, UO2, UF4, UO3, U3O8 und UO2F2 · 2 H2O bei Temperaturen zwischen 100 und 550 °C zu UF6. NF3 wird daher als potentieller Ersatz bisheriger Fluorierungsmittel im bestehenden nuklearen Brennstoffkreislauf sowie in der Wiederaufarbeitung der flüchtigen Actinoidenverbindungen angesehen.
Eigenschaften
Physikalische Eigenschaften
Uranhexafluorid bildet farblose Kristalle, die unter Normaldruck (1.013,25 hPa) bei 56,54 °C sublimieren, das heißt direkt vom festen in den gasförmigen Zustand übergehen.

Es kann unbegrenzt bei Raumtemperatur in Quarz- oder Pyrex-Ampullen aufbewahrt werden, wenn sichergestellt ist, dass keine Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und eventuell vorhandener Fluorwasserstoff (HF) restlos entfernt wurde.
| Parameter für die Antoine-Gleichung lg P = A−B/(T+C); bei 64–116 °C | ||
| A | B | C |
|---|---|---|
| 6,99464 | 1126,288 | 221,963 |
| lg P = A−B/(T+C); bei > 116 °C | ||
| A | B | C |
| 7,69069 | 1683,165 | 302,148 |
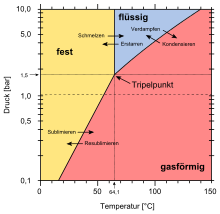
Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 64,05 °C und einem Druck von 1142 Torr (das sind ca. 1,5 bar oder 1500 hPa). Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich.
Der kritische Punkt, ab dem Flüssigkeit und Gas nicht mehr voneinander unterschieden werden können, liegt bei einer Temperatur (Tc) von 230,2 °C, einem Druck (pc) von 45,5 atm (46,1 bar), einem molaren Volumen (Vm, c) von 256,0 cm3/mol und einer Dichte (ρc) von 1,375 g/cm3. Der Dampfdruck bei 25 °C beträgt 153 mbar (153 hPa).
Die Flüchtigkeit von UF6 ist ähnlich der von Neptuniumhexafluorid (NpF6) und Plutoniumhexafluorid (PuF6); sie gehören zusammen zu den drei bisher bekannten Hexafluoriden der Actinoidenelemente.
Die Bildungsentropie (S0m) beträgt für festes UF6: −430,4 ± 1,5 J·K−1·mol−1, für gasförmiges UF6: −280,4 ± 1,5 J·K−1·mol−1. Die Sublimationsenthalpie (ΔHs) am Sublimationspunkt (56,54 °C) beträgt 48,23 kJ·mol−1; die Verdampfungsenthalpie (ΔHv) am Tripelpunkt (64,05 °C) beträgt 28,76 kJ·mol−1.
Uranhexafluorid ist paramagnetisch; die molare magnetische Suszeptibilität χmol beträgt 43 · 10−6 cm3·mol−1.
Kristall- und Molekülstruktur
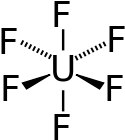
Uranhexafluorid ist eine kovalente Verbindung und kein Salz. Das UF6-Molekül ist oktaedrisch (Oh); im gasförmigen Zustand beträgt die U–F-Bindungslänge 199,6 pm.
-
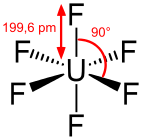
Bindungslänge und -winkel beim gasförmigen Uranhexafluorid
-
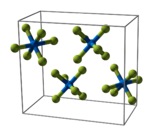
Elementarzelle des Uranhexafluorids
Uranhexafluorid kristallisiert im orthorhombischen Kristallsystem bei 293 K (20 °C) in der Raumgruppe Pnma (Nr. 62) mit den Gitterparametern a = 990,0 pm, b = 896,2 pm und c = 520,7 pm mit vier Formeleinheiten pro Elementarzelle Im Kristall zeigen die Moleküle eine leichte Abweichung von der regulären oktaedrischen Koordination. Bei 293 K (20 °C) betragen die gemessenen Abweichungen aus den Librationsbewegungen der Fluor-Atome +1,5 pm für die U–F- und +2,0 pm für die F–F-Abstände. Die korrigierten Abstände betragen für U–F 199,2–200,4 pm, für F–F 280,4–282,6 pm und der F–U–F-Winkel 89,42(17)–90,20(11)°.
Beim Abkühlen auf 193 K (−80 °C) verringern sich die Gitterparameter auf a = 984,3 pm, b = 892,0 pm und c = 517,3 pm. Die hexagonale Kugelpackung neigt zu größerer Regelmäßigkeit, die F–F-Abstände außerhalb eines UF6-Oktaeders verkürzen sich. Die Oktaeder der Moleküle sind fast regelmäßig mit einem mittleren U–F-Abstand von 198 pm, einer mittleren F–F-Kantenlänge von 280 pm, und einem F–U–F-Winkel von 90,0° bei 193 K.
Bei weiterer Abkühlung auf 77 K (−196 °C) verringern sich die Metall-Fluor-Bindungslängen nicht wesentlich, aber die Atomkoordinaten nähern sich weiter an die idealen Koordinaten der hexagonalen Kugelpackung der Fluoratome an.
Chemische Eigenschaften
Uranhexafluorid ist beständig in trockener Luft. Es reagiert hingegen sehr heftig mit Wasser (schon durch Luftfeuchtigkeit), wobei das wasserlösliche Uranylfluorid (UO2F2) und Fluorwasserstoff (HF) entstehen. HF bildet im überschüssigen Wasser stark ätzende Flusssäure.
UF6 ist ein kräftiges Fluorierungs- und Oxidationsmittel. Mit den meisten Metallen und Legierungen (z.B. Eisen, Aluminium-Magnesium-Legierungen, Edelstähle) reagiert es unter Bildung von Metallfluoriden, bei Raumtemperatur sehr langsam, bei erhöhten Temperaturen etwas schneller. Da die gebildeten Fluoride schwerflüchtig sind, bilden sie auf den betreffenden Oberflächen Ablagerungen, die die Weiterreaktion verhindern können. Vor allem Nickel ist chemisch sehr widerstandsfähig. Synthetische Hochpolymere, wie z.B. Teflon und einige Copolymere, weisen ebenfalls eine gute Beständigkeit gegenüber UF6 auf. Organische Verbindungen reagieren dagegen bereits bei Raumtemperatur durch Fluorierung mit UF6; dabei bilden sich HF und UF4 unter Abscheidung von Kohlenstoff. Sauerstoffhaltige organische Verbindungen wie z.B. Ethanol oder Diethylether reagieren schnell unter Abscheidung von Uranylfluorid und Bildung von HF.
Verwendung

Uranhexafluorid dient zur Trennung der Uranisotope nach dem Gasdiffusionsverfahren oder mittels Gasultrazentrifugen. Es ist hierzu ideal geeignet, da es sich im Gegensatz zu den meisten anderen Uranverbindungen leicht in die Gasphase überführen lässt und da Fluor ein Reinelement ist: Es kommt nur ein Fluorisotop (19F) in der Natur vor; alle natürlichen Fluoratome haben exakt die gleiche Atommasse. Daher sind die Massenunterschiede der Uranhexafluoridmoleküle, die bei der Isotopentrennung ausgenutzt werden – wie erwünscht – nur auf die Massenunterschiede der Uranisotope 238U und 235U zurückzuführen. Uranhexafluorid ist damit ein Bestandteil des nuklearen Brennstoffkreislaufs. Zur weiteren Verwendung in Druck- und Siedewasserreaktoren wird angereichertes Uranhexafluorid zu Brennelementefabriken transportiert, um dort erst zu Urandioxid und schließlich zu Brennelementen weiterverarbeitet zu werden.
Für die Wiederaufarbeitung abgebrannter Brennelemente wurde zur Abtrennung des Urans (95 % der Gesamtmasse) vorgeschlagen, das Material fein zu zerkleinern und mit elementarem Fluor zu behandeln („direkte Fluorierung“). Die dabei entstehenden flüchtigen Fluoride (hauptsächlich UF6 und geringe Mengen NpF6) lassen sich leicht von den nichtflüchtigen Fluoriden, z.B. Plutonium(IV)-fluorid (PuF4), Americium(III)-fluorid (AmF3), Curium(III)-fluorid (CmF3) sowie den Fluoriden der meisten Spaltprodukte, abtrennen. Neptuniumhexafluorid (NpF6) und Plutoniumhexafluorid (PuF6) sind gegenüber UV-Licht empfindlich und zersetzen sich zu den Tetrafluoriden und Fluor. Sie lassen sie sich daher photochemisch aus einem Gemisch mit UF6 entfernen.
Transport und Lagerung

Da die Stätten der Produktion, der Isotopentrennung und der Weiterverarbeitung an unterschiedlichen Orten liegen, sind Transport und Lagerung von Uranhexafluorid erforderlich. Der Transport erfolgt auf Straßen, per Bahn oder Schiff. Hierzu stehen spezielle Tanks zur Verfügung, die den Normen ANSI N14.1 oder ISO 7195 entsprechen müssen. Gebräuchlich sind vor allem Stahltanks der Typen 48 F oder 48 Y. Sie haben einen Durchmesser von 48 Zoll (ca. 122 cm), eine Wandstärke von 16 mm und fassen bis zu 12,5 Tonnen. Für den Transport des angereicherten Uranhexafluorids werden kleinere Behälter des Typs 30 B benutzt. Sie haben einen Durchmesser von 30 Zoll (ca. 76 cm) mit einem Inhalt von 2,277 Tonnen. Die Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt (GGVSEB) enthält dazu eine Regelung zur Zulassung der Bauart von Verpackungen für nicht spaltbares oder spaltbares freigestelltes Uranhexafluorid.
Die Transporte sind von der Internationalen Atomenergieorganisation geregelt. Sie sind jedoch umstritten und führten unter anderem zu mehreren Anfragen im Deutschen Bundestag und u.a. im Landtag von Baden-Württemberg. In der öffentlichen Diskussion stehen diese Transporte insbesondere, nachdem am 1. Mai 2013 auf dem Uranhexafluorid befördernden Frachter Atlantic Cartier im Hamburger Hafen ein Feuer ausgebrochen war und es erhebliche Schwierigkeiten gab, dieses zu löschen.

In den Vereinigten Staaten lagerten im Jahr 2000 mindestens 46.422 Fässer mit Uranhexafluorid an mindestens drei Orten: Auf dem Gelände der K-25 genannten, ehemaligen Urananreicherungsanlage bei Oak Ridge im Bundesstaat Tennessee lagerten 4.683 Fässer, 28.351 in der Urananreicherungsanlage in Paducah in Kentucky und 13.388 in der Urananreicherungsanlage in Portsmouth in Ohio.

Es gab in den Vereinigten Staaten mehrere Unfälle mit Uranhexafluorid. Einer ereignete sich im Jahr 1986 an einer Anlage der Sequoyah Fuels Corporation in der Nähe von Gore im Bundesstaat Oklahoma. Als man einen überfüllten Tank erwärmte, um übergelaufenes Material zu entfernen, platzte der Tank auf.
Physiologische Wirkungen und Sicherheitshinweise
Uranhexafluorid wirkt hauptsächlich auf drei verschiedene Weisen auf den menschlichen Körper:
- Es ist eine sehr aggressive Substanz, die jedes Gewebe angreift. Beim Kontakt des Gases mit Körperflüssigkeiten bildet sich Flusssäure, die auf der Haut und den Schleimhäuten der Atemwege Verätzungen hervorruft. Die Exposition des Menschen gegenüber dem Gas wirkt sich zunächst auf die Augen und Atemwege aus und verursacht Reizungen, Verlust des Sehvermögens, Husten und übermäßige Bildung von Speichel und Auswurf. Nach längerer Exposition führt dies zu Pneumonitis und Lungenödemen und kann zum Tod führen.
- Es ist – wie alle sechswertigen Uranverbindungen – sehr giftig beim Einatmen und Verschlucken. Außerdem besteht die Gefahr der Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft.
- Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig. 238U hat eine Halbwertszeit von 4,468 Milliarden Jahren und ist wie die anderen natürlichen Isotope (234U und 235U) ein α-Strahler. Die spezifische Aktivität von 238U beträgt 12,35 Bq/mg. 235U hat eine Halbwertszeit von 704 Millionen Jahren. Es ist spaltbar und hat in natürlichem Uranvorkommen einen Anteil von etwa 0,7 %. Angereichertes Uranhexafluorid ist aufgrund der niedrigeren Halbwertszeit deutlich aktiver.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.01. 2024




