
Gadolinium
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Gadolinium ist ein chemisches Element mit dem Elementsymbol Gd und der Ordnungszahl 64. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden.
Geschichte
Das Element wurde erstmals 1880 vom Schweizer Chemiker Jean Charles Galissard de Marignac entdeckt. Er untersuchte dabei die Bestandteile von Samarskit und ihre unterschiedliche Löslichkeit in Kaliumsulfat-Lösungen. Es bildeten sich je nach Löslichkeit mehrere Fraktionen. In einer der Fraktionen fand er im Absorptionsspektrum die Spektrallinien eines unbekannten Elements. Dieses nannte er, da er nicht ausreichend Material für eine exakte Bestimmung erhalten konnte, Yα. Daneben fand er in einer weiteren Fraktion das ihm ebenfalls unbekannte Yβ, hierbei stellte sich jedoch schnell heraus, dass es sich um das schon von Marc Delafontaine und Paul Émile Lecoq de Boisbaudran gefundene Samarium handelte.[10] Nachdem die Existenz von Yα von William Crookes[11] und Paul Émile Lecoq de Boisbaudran bestätigt werden konnte, nannte Lecoq de Boisbaudran am 19. April 1886 das neue Element in Absprache mit Marignac Gadolinium, zu Ehren des finnischen Chemikers Johan Gadolin, mit dem Symbol Gd.[12][13]
Metallisches Gadolinium wurde erstmals 1935 von Félix Trombe gewonnen. Er nutzte dafür die elektrolytische Reduktion einer Schmelze aus Gadolinium(III)-chlorid, Kaliumchlorid und Lithiumchlorid bei 625–675 °C an Cadmiumelektroden.[14] Kurze Zeit später entdeckte er zusammen mit Georges Urbain und Pierre-Ernest Weiss den Ferromagnetismus des Elements.[15]
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Gadolinium, Gd, 64 |
| Elementkategorie | Lanthanoide |
| Gruppe, Periode, Block | La, 6, f |
| Aussehen | silbrig weiß |
| CAS-Nummer | |
| EG-Nummer | 231-162-2 |
| ECHA-InfoCard | |
| Massenanteil an der Erdhülle | 5,9 ppm (45. Rang)[1] |
| Physikalisch[2] | |
| Aggregatzustand | fest |
| Kristallstruktur | hexagonal |
| Dichte | 7,886 g/cm3 (25 °C)[6] |
| Magnetismus | ferromagnetisch (Curie-Temp. 292,5 K)[7] |
| Schmelzpunkt | 1585 K (1312 °C) |
| Siedepunkt | 3273 K[8] (3000 °C) |
| Molares Volumen | 19,90 · 10−6 m3/mol |
| Verdampfungsenthalpie | 301 kJ/mol[8] |
| Schmelzenthalpie | 10,0 kJ/mol |
| Schallgeschwindigkeit | 2680 m/s bei 293,15 K |
| Elektrische Leitfähigkeit | 0,763 · 106 S·m−1 |
| Wärmeleitfähigkeit | 11 W·m−1·K−1 |
| Chemisch[2] | |
| Oxidationszustände | +2, +3 |
| Elektronegativität | 1,20 (Pauling-Skala) |
Vorkommen
Gadolinium ist auf der Erde ein seltenes Element, sein Anteil an der kontinentalen Erdkruste beträgt etwa 6,2 ppm.[16]
Das Element kommt in vielen Mineralen der Seltenerdmetalle in unterschiedlichen Gehalten vor. Besonders hoch ist der Gadoliniumgehalt in Mineralen der Yttererden wie Xenotim. In Xenotimvorkommen aus Malaysia beträgt der Gadoliniumanteil etwa 4 %. Aber auch Monazit enthält je nach Lagerstätte 1,5 bis 2 % des Elements, in Bastnäsit ist der Anteil mit 0,15 bis 0,7 % dagegen geringer.[17] Es ist nur ein einziges Mineral bekannt, in dem Gadolinium das Seltenerdmetall mit dem höchsten Anteil ist. Dabei handelt es sich um das sehr seltene Uranylcarbonat Lepersonnit-(Gd) mit der chemischen Zusammensetzung Ca(Gd,Dy)2(UO2)24(SiO4)4(CO3)8(OH)24 · 48H2O.[18]
Gewinnung und Darstellung
Aufgrund der nur geringen Mengen des in den Erzen enthaltenen Gadoliniums und der Ähnlichkeit mit den anderen Lanthanoiden ist dessen Separierung schwierig. Nach dem Aufschluss der Ausgangsmaterialien wie Monazit oder Bastnäsit mit Schwefelsäure oder Natronlauge sind verschiedene Wege zur Abtrennung möglich. Neben Ionenaustausch ist besonders ein auf der Flüssig-Flüssig-Extraktion basierendes Verfahren wichtig. Dabei wird bei Bastnäsit als Ausgangsmaterial zunächst das Cer in Form von Cer(IV)-oxid abgetrennt und die verbleibenden Seltenen Erden in Salzsäure gelöst. Daraufhin werden mit Hilfe einer Mischung von DEHPA (Di(2-ethylhexyl)phosphorsäure) und Kerosin in Flüssig-Flüssig-Extraktion Europium, Gadolinium, Samarium und die schwereren Seltenerdmetalle von den leichten getrennt. Ersteres lässt sich chemisch durch Reduktion zu zweiwertigem Europium und Fällung als schwerlösliches Europium(II)-sulfat abtrennen. Für die Trennung von Gadolinium, Samarium und dem Rest wird wiederum die Flüssig-Flüssig-Extraktion genutzt. Die Mischung wird in verdünnter Salzsäure gelöst, mit einer Mischung von DEHPA und Trimethylbenzolen (Shellsol A) behandelt und in einer Mixer-Settler-Apparatur getrennt.[19][17]
Die Gewinnung elementaren Gadoliniums ist über die Reduktion von Gadolinium(III)-fluorid mit Calcium möglich.[17]
Gadolinium wird nur in geringerem Umfang produziert und benötigt. Wichtigster Produzent ist, wie bei allen Seltenerdmetallen, die Volksrepublik China.
Eigenschaften

Physikalische Eigenschaften
Das silbrigweiß bis grauweiß glänzende Metall der Seltenen Erden ist duktil und schmiedbar. Es kristallisiert in einer hexagonal-dichtesten Kristallstruktur mit den Gitterparametern a = 363 pm und c = 578 pm.[20] Oberhalb von 1262 °C geht die Struktur in eine kubisch-raumzentrierte Struktur über.[21]
Neben dieser Hochtemperaturphase sind mehrere Hochdruckphasen bekannt. Die Abfolge der Phasen entspricht dabei der der anderen Lanthanoide (außer Europium und Ytterbium). Auf die hexagonale Struktur folgt (jeweils bei Raumtemperatur) bei Drücken über 1,5 GPa eine Struktur vom Samarium-Typ, oberhalb von 6,5 GPa ist eine doppelt-hexagonale Kristallstruktur stabil. Eine kubisch-flächenzentrierte Packung ist bei Drücken zwischen 26 und 33 GPa am stabilsten. Bei noch größeren Drücken sind noch eine doppelt-kubisch-flächenzentrierte Struktur sowie das monokline Gd-VIII bekannt.[22][23]
Gadolinium ist neben Dysprosium, Holmium, Erbium, Terbium und Thulium eines der Lanthanoide, das ferromagnetisch ist. Mit einer Curie-Temperatur von 292,5 K (19,3 °C) besitzt es die höchste Curie-Temperatur aller Lanthanoide, nur Eisen, Cobalt und Nickel besitzen höhere.[24] Oberhalb dieser Temperatur ist es paramagnetisch mit einer magnetischen Suszeptibilität χm von 0,12.[7]
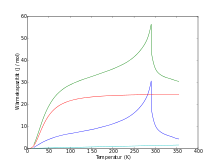
Aufgrund dieser magnetischen Eigenschaften hat Gadolinium auch eine sehr stark temperaturabhängige Wärmekapazität. Bei tiefen Temperaturen (unter 4 K) dominiert zunächst, wie bei Metallen üblich, die elektronische Wärmekapazität Cel (wobei Cel = γ·T mit γ = 6,38 mJ·mol−1·K−2 und T der Temperatur[25][26]). Für höhere Temperaturen ist die Debyesche Wärmekapazität (mit der Debye-Temperatur ΘD = 163,4 K[25]) ausschlaggebend. Unterhalb der Curie-Temperatur nimmt die Wärmekapazität dann stark zu, was auf das Spinsystem zurückzuführen ist. Sie erreicht 56 J·mol−1·K−1 bei 290 K, um bei höheren Temperaturen fast schlagartig auf unter 31 J·mol−1·K−1 einzubrechen.[27]
Gadolinium ist Bestandteil keramischer Hochtemperatur-Supraleiter des Typs Ba2GdCu3O7-x mit einer Sprungtemperatur von 94,5 K.[28] Das reine Element ist nicht supraleitfähig.[29]
Gadolinium hat mit 49.000 barn wegen seines enthaltenen Isotops Gd-157 (mit 254.000 barn) den höchsten Einfangquerschnitt für thermische Neutronen aller bekannten stabilen Elemente. Nur das radioaktive Xe-135 erreicht mit 2,65 Millionen barn reichlich das Zehnfache von Gd-157. Die hohe Abbrandrate (burn-out-rate) schränkt eine Verwendung als Steuerstab in Kernreaktoren aber erheblich ein.
Chemische Eigenschaften
In trockener Luft ist Gadolinium beständig, in feuchter Luft bildet es eine nichtschützende, lose anhaftende und abblätternde Oxidschicht aus. Mit Wasser reagiert es langsam. In verdünnten Säuren wird es gelöst. Stäube von metallischem Gadolinium sind feuer- und explosionsgefährlich.
Verwendung
Gadolinium wird zur Herstellung von Gadolinium-Yttrium-Granat für Mikrowellenanwendungen verwendet. Oxysulfide dienten zur Herstellung von grünem Leuchtstoff für nachleuchtende Bildschirme (Radar).
Gadolinium-Gallium-Granat wurde zur Herstellung von Magnetblasenspeichern genutzt.
Zusätze von 1 % Gadolinium erhöhen die Bearbeitbarkeit und die Hochtemperatur- und Oxidationsbeständigkeit von Eisen- und Chromlegierungen. Entsprechende Gadolinium-Eisen-Kobalt-Legierungen können zur optomagnetischen Datenspeicherung eingesetzt werden.
Gadolinium könnte, da es einen Curie-Punkt nahe der Zimmertemperatur besitzt, in Kühlgeräten, die nach dem Prinzip der adiabatischen Magnetisierung funktionieren, Verwendung finden. Solche Kühlgeräte würden ohne Ozonschicht-schädigende Fluorchlorkohlenwasserstoffe (FCKW) auskommen und besäßen keine verschleißenden mechanischen Teile. Umgekehrt lässt sich ein Motor durch Versorgung mit warmem und kaltem Wasser betreiben. Dadurch ließe sich z. B. die Restenergie aus warmen industriellen Abwässern gewinnen.[30]
Gadolinium wird in Form von Gadoliniumoxid in modernen Brennelementen als abbrennbares Absorbermaterial verwendet, das nach einem Brennelementewechsel zu Beginn des Betriebszyklus die durch einen Überschuss an Kernbrennstoff entstehende zu hohe Reaktivität des Reaktors begrenzt. Mit zunehmendem Abbrand der Brennelemente wird auch das Gadolinium abgebaut.[31] Durch Neutroneneinfang werden dabei immer schwerere Isotope des Gadoliniums gebildet bis schließlich Transmutation erfolgt.
Mit Terbium dotiertes Gadolinium-Oxysulfid (Gd2O2S:Tb) ist ein in der Röntgentechnik häufig eingesetzter Szintillator. Gd2O2S:Tb emittiert Licht mit einer Wellenlänge von 545 nm.[32]
MRT-Kontrastmittel
Intravenös injizierte Gadolinium(III)-Verbindungen wie Gadopentetat-Dimeglumin dienen als Kontrastmittel bei Untersuchungen im Kernspintomographen. Durch die sieben ungepaarten Elektronen in der f-Schale sind Gadoliniumionen stark paramagnetisch. Das Kontrastmittel ermöglicht so den umgebenden Protonen – im Wesentlichen Wasser – schneller zu relaxieren. Dies erhöht die Kontrastunterschiede zwischen verschiedenen Geweben in einer MRT-Aufnahme erheblich. Gadolinium wird bspw. intravenös verabreicht, um Tumoren und entzündliche Veränderungen im Gehirn darzustellen. Bei Störungen der Blut-Liquor-Schranke kommt es zu einer Anreicherung im verdächtigen Bereich und liefert somit wichtige diagnostische Informationen.
Wegen der hohen Giftigkeit von freien Gadolinium-Ionen werden in MRT-Kontrastmitteln Komplexierungsmittel mit hoher Komplexierungskonstante verwendet, wie die Chelate DTPA (Diethylentriaminpentaessigsäure) und DOTA (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure). Gadolinium kann sich nach Angaben der US-amerikanischen Arzneimittelbehörde FDA im Gehirn ablagern[33]. Der Berufsverband Deutscher Nuklearmediziner (BDN) rät, die Mittel vorerst nur bei unvermeidbaren Untersuchungen einzusetzen.[34]
Verbindungen
- Gadolinium(III)-oxid Gd2O3
- Gadolinium(III)-fluorid GdF3
- Gadolinium(III)-chlorid GdCl3
- Gadolinium(III)-bromid GdBr3
- Gadolinium(III)-iodid GdI3
- Gadolinium(II)-iodid GdI2; schwarze Substanz, die ferromagnetisch ist.
- Gadolinium(III)-nitrat Gd(NO3)3
- Gallium-Gadolinium-Grana Ga3Gd5O12
- Gadotersäure
- Gadopentetat-Dimeglumin
Physiologie
Es ist keine biologische Funktion des Gadoliniums bekannt.
Toxizität
Freie Gadolinium-Ionen verhalten sich ähnlich wie Calcium-Ionen, das heißt, sie werden vorwiegend in der Leber und im Knochensystem eingebaut und können dort über Jahre verbleiben. Freies Gadolinium beeinflusst außerdem als Calciumantagonist – die Ionenradien von Calcium und Gadolinium sind nahezu gleich – die Kontraktilität des Myokards und hemmt das Gerinnungssystem.[35]
Intravenös applizierte Lösungen von freien Gadolinium-Ionen wirken akut toxisch. Von der Toxizität betroffen sind unter anderem die glatte und die quergestreifte Muskulatur, die Funktion der Mitochondrien und die Blutgerinnung.[36]
Die Toxizität von freiem Gadolinium ist als hoch einzustufen. In komplexierter Form, so wie das Gadolinium in den zugelassenen Kontrastmitteln vorliegt, ist es dagegen unter Berücksichtigung der Kontraindikationen im Allgemeinen gut verträglich. Seit 2006 gibt es zunehmend Berichte, dass es bei niereninsuffizienten Patienten nach Gabe verschiedener Chelate des Gadoliniums, insbesondere Gd-DTPA, zum Krankheitsbild der nephrogenen systemischen Fibrose kommen kann. Eine neue Studie liefert Hinweise darauf, dass Gadolinium in Kontrastmitteln nach mehrmaligen MRTs zu Ablagerungen und eventuell auch Strukturschädigungen im Gehirn führen könnte.[37] Ob es wirklich zu einer Schädigung kommt, konnte jedoch noch nicht festgestellt werden.
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus
 www.webelements.com (Gadolinium) entnommen.
www.webelements.com (Gadolinium) entnommen.
- ↑
 CIAAW, Standard Atomic Weights Revised 2013.
CIAAW, Standard Atomic Weights Revised 2013.
- ↑ Hochspringen nach: a b
c d
e Eintrag zu
 gadolinium
in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.:
NIST, Gaithersburg, MD.
doi:
gadolinium
in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.:
NIST, Gaithersburg, MD.
doi:  10.18434/T4W30F
(
10.18434/T4W30F
(  physics.nist.gov/asd).
physics.nist.gov/asd).
- ↑ Hochspringen nach: a b c
d e Eintrag zu
 gadolinium bei WebElements,
gadolinium bei WebElements,
 www.webelements.com.
www.webelements.com.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- ↑ Hochspringen nach: a b Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ Hochspringen nach: a b Yiming Zhang, Julian R. G.
Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: ournal of Chemical & Engineering Data.
56, 2011, S. 328–337,
 doi:10.1021/je1011086.
doi:10.1021/je1011086.
- ↑ Hochspringen nach: a b Eintrag zu
 Gadolinium, Pulver in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Gadolinium, Pulver in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Jean Charles Galissard de Marignac: Sur les terres de la samarskite. In: Comptes Rendus.
1880, 90, S. 899–903 (
 Digitalisat auf
Gallica.fr).
Digitalisat auf
Gallica.fr).
- ↑ William Crookes: Sur la terre Yα. In: Comptes Rendus. 1886, 102, S. 646–647
(
 Digitalisat auf
Gallica.fr).
Digitalisat auf
Gallica.fr).
- ↑ Paul Émile Lecoq de Boisbaudran: Le Yα de Marignac est définitevement nomme Gadolinium. In:
Comptes Rendus. 1886, 102, S. 902 (
 Digitalisat auf
Gallica.fr).
Digitalisat auf
Gallica.fr).
- ↑ W. Crookes: On Some New Elements in Gadolinite and Samarskite, Detected Spectroscopically. In:
Proceedings of the Royal Society of London. 40, 1886, S. 502–509,
 doi:10.1098/rspl.1886.0076.
doi:10.1098/rspl.1886.0076.
- ↑ Félix Trombe: L'isolement de gadolinium. In: Comptes Rendus. 1935, 200, S. 459–461
(
 Digitalisat auf Gallica.fr).
Digitalisat auf Gallica.fr).
- ↑ Georges Urbain, Pierre-Ernest Weiss Félix Trombe: Un nouveau métal ferromagnetique, le gadolinium.
In: Comptes Rendus. 1935, 200, S. 2132–2134 (
 Digitalisat
auf Gallica.fr).
Digitalisat
auf Gallica.fr).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea, S. 14-18.
- ↑ Hochspringen nach: a b
c Ian McGill: Rear Earth Elements. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012,
 doi:10.1002/14356007.a22_607.
doi:10.1002/14356007.a22_607.
- ↑ M. Deliens und P. Piret: Bijvoetite et lepersonnite, carbonates hydratés d'uranyle et des terres rares
de Shinkolobwe, Zaire. In: Canadian Mineralogist. 1982, 20, S. 231–238
(
 Abstract in American Mineralogist (PDF-Datei; 623 kB)).
Abstract in American Mineralogist (PDF-Datei; 623 kB)).
- ↑ Clifford G. Brown, Leonard G. Sherrington: Solvent extraction used in industrial separation of rare
earths. In: Journal of Chemical Technology and Biotechnology. 29, 1979, S. 193–209,
 doi:10.1002/jctb.503290402.
doi:10.1002/jctb.503290402.
- ↑ J. Banister, S. Legvold, F. Spedding: Structure of Gd, Dy, and Er at Low Temperatures. In:
Physical Review. 94, 1954, S. 1140–1142,
 doi:10.1103/PhysRev.94.1140.
doi:10.1103/PhysRev.94.1140.
- ↑ F.H. Spedding, J.J. Hanak, A.H. Daane: High temperature allotropy and thermal expansion of the
rare-earth metals. In: Journal of the Less Common Metals. 3, 1961, S. 110–124,
 doi:10.1016/0022-5088(61)90003-0.
doi:10.1016/0022-5088(61)90003-0.
- ↑ W.B. Holzapfel: Structural systematics of 4f and 5f elements under pressure. In:
Journal of Alloys and Compounds. 223, 1995, S. 170–173,
 doi:10.1016/0925-8388(94)09001-7.
doi:10.1016/0925-8388(94)09001-7.
- ↑ D. Errandonea, R. Boehler, B. Schwager, M. Mezouar: Structural studies of gadolinium at high pressure
and temperature. In: Physical Review B. 75, 2007,
 doi:10.1103/PhysRevB.75.014103.
doi:10.1103/PhysRevB.75.014103.
- ↑ C. Rau, S. Eichner: Evidence for ferromagnetic order at gadolinium surfaces above the bulk Curie
temperature. In: Physical Review B. 34, 1986, S. 6347–6350,
 doi:10.1103/PhysRevB.34.6347.
doi:10.1103/PhysRevB.34.6347.
- ↑ Hochspringen nach: a b T.-W. Tsang, K. Gschneidner,
F. Schmidt, D. Thome: Low-temperature heat capacity of electrotransport-purified scandium, yttrium, gadolinium, and lutetium. In: Physical Review B. 31, 1985,
S. 235–244,
 doi:10.1103/PhysRevB.31.235.
doi:10.1103/PhysRevB.31.235.
- ↑ T.-W. E. Tsang, K. Gschneidner, F. Schmidt, D. Thome: Erratum: Low-temperature heat capacity of
electrotransport-purified scandium, yttrium, gadolinium, and lutetium. In: Physical Review B. 31, 1985, S. 6095–6095,
 doi:10.1103/PhysRevB.31.6095.
doi:10.1103/PhysRevB.31.6095.
- ↑ F. Jelinek, B. Gerstein, M. Griffel, R. Skochdopole, F. Spedding: Re-Evaluation of
Some Thermodynamic Properties of Gadolinium Metal. In: Physical Review. 149, 1966, S. 489–490,
 doi:10.1103/PhysRev.149.489.
doi:10.1103/PhysRev.149.489.
- ↑ X.T. Xu, J.K. Liang, S.S. Xie, G.C. Che, X.Y. Shao, Z.G. Duan, C.G. Cui: Crystal structure and
superconductivity of Ba?Gd?Cu?O system. In: Solid State Communications. 63, 1987, S. 649–651,
 doi:10.1016/0038-1098(87)90872-6.
doi:10.1016/0038-1098(87)90872-6.
- ↑ Cristina Buzea, Kevin Robbie: Assembling the puzzle of superconducting elements: a review. In:
Superconductor Science and Technology. 18, 2005, S. R1–R8,
 doi:10.1088/0953-2048/18/1/R01.
doi:10.1088/0953-2048/18/1/R01.
- ↑
 Grüner Strom aus neuen Quellen, NZZ, 19.
November 2016.
Grüner Strom aus neuen Quellen, NZZ, 19.
November 2016.
- ↑ Patent
 DE4423128A1:
Reaktorkern für einen Siedewasserkernreaktor. Veröffentlicht am 26. Januar 1995.
DE4423128A1:
Reaktorkern für einen Siedewasserkernreaktor. Veröffentlicht am 26. Januar 1995.
- ↑ Christos M. Michail:
 Luminescence Efficiency of
Gd2O2S:Eu Powder Phosphors as X-ray to Light Converter (vom 23. April 2015 im Internet Archive) (PDF; 239 kB), in: e-Journal of Science & Technology.
Luminescence Efficiency of
Gd2O2S:Eu Powder Phosphors as X-ray to Light Converter (vom 23. April 2015 im Internet Archive) (PDF; 239 kB), in: e-Journal of Science & Technology.
- ↑
 FDA evaluating
the risk of brain deposits with repeated use of gadolinium-based contrast agents for magnetic resonance imaging (MRI). In: FDA Drug Safety Communication.
Food and Drug Administration, 18. August 2017, abgerufen am 10. Juni 2025.
FDA evaluating
the risk of brain deposits with repeated use of gadolinium-based contrast agents for magnetic resonance imaging (MRI). In: FDA Drug Safety Communication.
Food and Drug Administration, 18. August 2017, abgerufen am 10. Juni 2025.
- ↑ Kerstin Ullrich:
 MRT-Kontrastmittel kann im
Gehirn zurückbleiben. In: Pressemitteilungen. Berufsverband Deutscher Nuklearmediziner e. V., 5. Februar 2016, abgerufen am 10. Juni 2025.
MRT-Kontrastmittel kann im
Gehirn zurückbleiben. In: Pressemitteilungen. Berufsverband Deutscher Nuklearmediziner e. V., 5. Februar 2016, abgerufen am 10. Juni 2025.
- ↑ Jens Kühn: Physikochemische Eigenschaften von MRT Kontrastmitteln.
- ↑
 Sichere MRT-Diagnostik mit Gadotersäure.
In: universimed.com. 24. Mai 2011, archiviert vom Original.
Sichere MRT-Diagnostik mit Gadotersäure.
In: universimed.com. 24. Mai 2011, archiviert vom Original.
- ↑ Tomonori Kanda, Kazunari Ishii, Hiroki Kawaguchi,
Kazuhiro Kitajima, Daisuke Takenaka: High Signal Intensity in the Dentate Nucleus and Globus Pallidus on Unenhanced T1-weighted MR Images: Relationship with Increasing
Cumulative Dose of a Gadolinium-based Contrast Material. In: Radiology. 2013, S. 131669,
 doi:10.1148/radiol.13131669.
doi:10.1148/radiol.13131669.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.01. 2026
