Aufschluss (Chemie)
Ein Aufschluss ist ein Vorgang der anorganisch-chemischen Analytik, in dem schwerlösliche Stoffe, sehr häufig Oxide, Silikate oder Sulfate, unter Zuhilfenahme von Aufschlussmitteln in eine säure- oder wasserlösliche Verbindung überführt werden.
Ein chemisches Lösen kann jedoch die Substanz und die Matrix chemisch verändern. Mögliche Fehlerquellen beim Aufschluss sind:
- Substanzverlust durch Verflüchtigung
- Adsorption an Aufschlussgefäßen
- Kontamination durch Aufschlussmittel
Soda-Pottasche-Aufschluss
Beim Soda-Pottasche-Aufschluss, auch alkalischer Aufschluss genannt, wird ein Gemisch aus Soda (Natriumcarbonat) und Pottasche (Kaliumcarbonat) im Verhältnis 51,5 % : 48,5 % (Eutektisches Gemisch) hergestellt und in etwa sechsfacher Menge zusammen mit der Stoffprobe aufgeschmolzen. Der Zusatz von Kaliumcarbonat dient primär dem Herabsetzen der Schmelztemperatur der Mischung von über 850 °C auf ca. 712 °C.
Beispiele:
- Soda-Pottasche-Aufschluss von Aluminiumoxid
- Soda-Pottasche-Aufschluss von Bariumsulfat
Saurer Aufschluss
Zum Aufschluss basischer Metalloxide eignet sich das Aufschmelzen mit Kaliumhydrogensulfat im Verhältnis 1 : 6.
- Der Aufschluss erfolgt durch Schwefeltrioxid, das zu Sulfatanionen weiterreagiert.
Beispiele:
- Aufschluss von Eisen(III)-oxid mit Kaliumhydrogensulfat
- Aufschluss von Eisen(III)-oxid mit Kaliumdisulfat (Verhältnis 1 : 3)
Freiberger Aufschluss
Der Freiberger Aufschluss, benannt nach der Bergakademie Freiberg, wird auch als sulfurierender Aufschluss bezeichnet. Schwerlösliche Oxide von Metallionen, die Thiosalze bilden, können zu löslichen Thioverbindungen umgesetzt werden. Dazu wird die Substanz mit der sechsfachen Menge eines Gemisches aus gleichen Teilen Schwefel, Kaliumcarbonat oder Natriumcarbonat geschmolzen.
Beispiel: Freiberger Aufschluss von Zinnstein SnO2 zu Thiostannat-Ionen SnS32−
Oxidationsschmelze
Säureunlösliche oxidierbare Substanzen wie Chrom(III)-oxid und Braunstein können unter Zuhilfenahme einer Oxidationsschmelze aufgeschlossen werden. Hierzu wird die Substanz mit bis zur dreifachen Menge einer Mischung aus Natriumcarbonat und Kaliumnitrat im Porzellantiegel aufgeschmolzen. Dabei wird die Substanz oxidiert und das zugesetzte Nitrat zu Nitrit reduziert.
Die Oxidationsschmelze ist gleichzeitig in der qualitativ-anorganischen Analytik eine Nachweisreaktion für Chrom- und Mangansalze in der Ammoniumsulfidgruppe im Kationentrennungsgang.
Beispiele:
- Oxidationsschmelze von grünem Chrom(III)-oxid zu gelbem Chromat
- Oxidationsschmelze von Eisen(II)-chromit (Chromit) mit Kaliumcarbonat und Natriumnitrat zu gelbem Chromat und Eisen(III)-oxid
-
3 Tiegel mit Oxidationsschmelzen als Nachweisreaktion für Mangan und Chrom: Blaugrün als Manganat(VI), gelb aus Chromat.
-
 Mangan in der Oxidationsstufe V in der Oxidationsschmelze zeigt eine charakteristische Färbung. Durch erneutes Glühen mit Kaliumhydroxid kann das Ergebnis verbessert werden, da Manganat(V) nur im alkalischen stabil ist.
Mangan in der Oxidationsstufe V in der Oxidationsschmelze zeigt eine charakteristische Färbung. Durch erneutes Glühen mit Kaliumhydroxid kann das Ergebnis verbessert werden, da Manganat(V) nur im alkalischen stabil ist. -
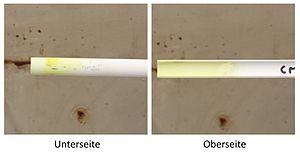 Chrom in der Oxidationsschmelze diffundiert durch die Magnesiarinne bis zur Unterseite hindurch.
Chrom in der Oxidationsschmelze diffundiert durch die Magnesiarinne bis zur Unterseite hindurch.
Weitere Verfahren
Eine weitere Methode zum Aufschluss schwerlöslicher Stoffe, speziell für Platin und Gold, ist das Kochen in Königswasser (Königswasseraufschluss) mit anschließendem Abrauchen (Entfernen von Säurerückständen).
Bei der alkalischen Oxidationsschmelze werden Edelmetall/Metall-Verbindungen aus Katalysatorenabbränden, Legierungen oder Erzkonzentraten in einer Natriumhydroxidschmelze mit einem oxidhaltigen Salz (etwa Chlorat oder Nitrat) bei hohen Temperaturen aufgeschlossen.
Für Feststoffe wird vereinzelt auch der Natrium-Aufschluss eingesetzt, besonders zur Analyse der einfachen Anionen (z.B. Chlorid-Ionen). Dabei wird die Probe mit elementarem Natrium im Glasröhrchen erhitzt, mit Wasser aufgenommen und filtriert.
Im Mikrowellenaufschluss wird Energie direkt auf Dipole polarer Lösungsmittel übertragen. Durch das sich rasch ändernde elektrische Feld der Mikrowelle werden dabei die Wassermoleküle in Rotationsbewegungen versetzt und erwärmen sich so durch „innere Reibung“. Ein Vorteil der Technik ist die gleichmäßige Erwärmung der Probe, die die Aufschlusszeit verkürzt.
Daneben gibt es einen Aufschluss mit einem Gemisch aus Chlorsäure und Perchlorsäure.
Literatur
- Gerhart Jander, Ewald Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel Verlag, Stuttgart 2006, ISBN 3-7776-1388-6.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.01. 2023