Carbonsäureamide
| Carbonsäureamide |
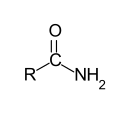 Allgemeine Struktur eines primären Amids mit einem Acylsubstituenten. |
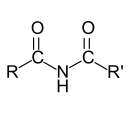 Allgemeine Struktur eines sekundären Amids mit zwei Acylsubstituenten |
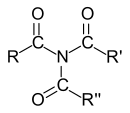 Allgemeine Struktur eines tertiären Amids mit drei Acylsubstituenten |
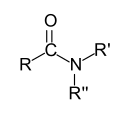 Allgemeine Struktur eines N,N-Dialkylamids aus einem sekundären Amin und einer Carbonsäure |
Carbonsäureamide sind Derivate des Ammoniaks sowie Derivate von primären und sekundären Aminen, bei denen ein oder mehrere Wasserstoffatome am Stickstoff durch Acylgruppen (R–CO–) ersetzt sind. Als Carbonsäure-Derivate sind sie auch eine Untergruppe der Amide. Carbonsäureamide sind Reaktionsprodukte von Carbonsäurechloriden oder Carbonsäureanhydriden mit Ammoniak oder Aminen. Carbonsäuren reagieren mit den Basen Ammoniak oder Aminen zu den jeweiligen Ammoniumsalzen, jedoch nicht ohne weiteres zu Carbonsäureamiden.
Nomenklatur
Die IUPAC-Nomenklatur unterscheidet bei Carbonsäureamiden entsprechend der Anzahl der Carboxygruppen am Stickstoff zwischen primären (eine Carboxygruppe), sekundären (zwei Carboxygruppen) und tertiären (drei Carboxygruppen) Amiden. Da jedoch nur für die unsubstituierten Mono- und Diacylderivate des Ammoniaks die Bezeichnung „primäres“, bzw. „sekundäres Amid“ eindeutig ist und im allgemeinen Sprachgebrauch primäre Amide mit einer Acylgruppe und zwei Kohlenwasserstoffsubstituenten am Stickstoff „tertiäre Amide“ genannt werden, wird die Klassifizierung in primäre, sekundäre und tertiäre Amide nicht empfohlen.
Diacylsubstituierte Amide – insbesondere solche die sich von Dicarbonsäuren ableiten – werden Imide genannt. Amide mit ein oder zwei Alkylgruppen am Stickstoffatom nennt man N-Alkylamide, bzw. N,N-Dialkylamide. Cyclische Amide werden als Lactame bezeichnet. Peptide und Proteine bestehen aus durch Amidbindungen verknüpften Aminosäuren. Diese Form der Bindung wird oft Peptidbindung genannt. Technisch sehr bedeutend sind die Polyamidfasern Nylon und Perlon.
Darstellung
Amide werden hauptsächlich aus der Reaktion von Carbonsäurederivaten mit Ammoniak oder einem Amin gewonnen. Im einfachsten Fall handelt es sich bei dem Carbonsäurederivat um ein Carbonsäurechlorid. Das freigesetzte Chlorwasserstoff (HCl) reagiert mit dem Amin zu einem Hydrochlorid, sodass das Amin in doppelter Menge eingesetzt werden muss:
Die Aminolyse von Carbonsäureestern liefert Carbonsäureamide und Alkohole:
Carbonsäuren selbst reagieren mit Aminen zu den entsprechenden Salzen:
Bei starkem Erhitzen dissoziieren die Salze aber teilweise zu Amin und Carbonsäure, die dann unter Wasserabspaltung das Amid ergeben:
Weitere wichtige Verfahren zur Synthese von Amiden sind die Ritter-Reaktion, die Hydrolyse von Nitrilen, die Beckmann-Umlagerung und die Haller-Bauer-Spaltung.
Eigenschaften
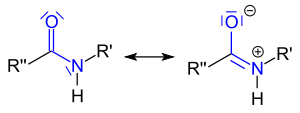
Die Säureamide sind mesomeriestabilisiert. Sowohl das Carbonyl-Kohlenstoff-, als auch das Stickstoff-Atom sind sp2-hybridisiert, alle drei Atome der Amidgruppe, sowie deren Nachbaratome liegen in einer Ebene. Die C-N-Bindung ist wesentlich kürzer (132 pm) als in anderen Kohlenstoff-Stickstoffverbindungen (147 pm), so dass man vom Vorliegen eines konjugierten Systems ausgehen kann, in dem durch Delokalisierung von π-Elektronen ein partieller Doppelbindungscharakter vorliegt.
Wegen der sp2-Hybridisierung des Stickstoffs ist dessen freies Elektronenpaar kein protonierbares n-Elektronenpaar, sondern (wie z.B. im Pyrrol) ein zur Konjugation beitragendes π-Elektronenpaar. Daher sind Amide äußerst schwache Basen und bilden nur mit konzentrierten Säuren Salze, die leicht hydrolytisch gespalten werden.
Die Säureamide verhalten sich wie schwache Säuren. Sie werden durch starke Basen wie Natriumamid zu Amidaten deprotoniert. Die Alkalisalze der Amidate werden durch Wasser leicht zersetzt. Die Bildung des Amidat-Ions durch Deprotonierung des Amids ist der erste Schritt bei der Hofmann-Umlagerung.
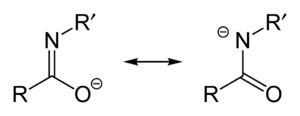
Eine tautomere Form der Amide sind die Imidsäuren.
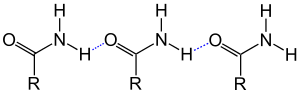
Als Ursache für die verhältnismäßig hohen Siedepunkte und Schmelzpunkte von Carbonsäureamiden im Vergleich zu den Carbonsäuren wird deren partieller Zwitterionencharakter (siehe Abbildung) und die Ausbildung von Wasserstoffbrücken (siehe Abbildung) angesehen.
Beispiele
| Carbonsäureamide | ||
| Name | Struktur | Anmerkungen |
| Formamid | 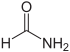 |
Das einfachste Amid, abgeleitet von der Ameisensäure und Ammoniak |
| N,N-Dimethylformamid (DMF) | 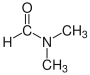 |
Verwendet als aprotisches Lösungsmittel in der organischen Chemie und leitet sich von Dimethylamin und Ameisensäure ab. |
| Acetamid (Ethanamid) | 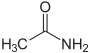 |
Amid der Essigsäure |
| Harnstoff | 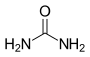 |
Ein Diamid, abgeleitet von der Kohlensäure. |
| ε-Caprolactam | 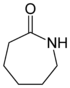 |
Ein cyclisches Carbonsäureamid. Ein Ausgangsstoff für Polyamid 6. |
| Phthalimid | 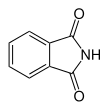 |
Das cyclische Imid der Phthalsäure. |
| N-Benzoylphthalimid | 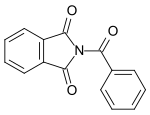 |
Benzoyliertes Phthalimid. |


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.09. 2025
