
Acetamid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | nicht festgelegt[2] | ||||||
| Toxikologische Daten | 7000 mg/kg (LD50, Ratte, oral)[2] | ||||||
Acetamid ist das Amid der Essigsäure. Acetamid wird als Lösungsmittel verwendet.
| Strukturformel | ||
|---|---|---|
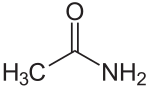
| ||
| Kristallsystem | trigonal[1] | |
| Raumgruppe | R3c (Nr. 161)[1] | |
| Gitterparameter | a = 1144 pm; c = 1350 pm mit 18 Formeleinheiten pro Elementarzelle[1] | |
| Allgemeines | ||
| Name | Acetamid | |
| Andere Namen |
| |
| Summenformel | C2H5NO | |
| Kurzbeschreibung | farblose, geruchslose hygroskopische Kristalle, die bei Verunreinigung mäuseartig riechen[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-473-5 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 59,07 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,16 g/cm3[2] | |
| Schmelzpunkt | ||
| Siedepunkt | 222 °C (Zersetzung)[2] | |
| Dampfdruck | 1,3 Pa (20 °C)[2] | |
| pKS-Wert | ||
| Löslichkeit | ||
| Dipolmoment | 3,68(3) D[7] (1,2 · 10−29 C · m) | |
| Brechungsindex | 1,4278[8] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | ||
Gewinnung und Darstellung
Acetamid wird durch Erhitzen von Ammoniumacetat unter Dehydratisierung hergestellt:[6]
Es kann unter anderem auch durch Umsetzung von Acetylchlorid und Ammoniak erzeugt werden:[6] In ähnlicher Weise reagieren auch Acetanhydrid oder Alkylacetate mit Ammoniak.[11]
Die direkte Reaktion von Keten mit Ammoniak ergibt ebenfalls Acetamid.[12]
Acetonitril kann in Gegenwart von sauren oder basischen Katalysatoren zum Acetamid hydrolysiert werden.[11]
Eigenschaften
Acetamid bildet farblose, hygroskopische, hexagonale Kristalle, die bei 81 °C schmelzen. Die molare Schmelzenthalpie beträgt 15,6 kJ·mol−1.[13] Es existiert noch eine zweite metastabile polymorphe Kristallform, die bei 69 °C mit einer Schmelzenthalpie von etwa 12,7 kJ·mol−1 schmilzt.[13] Die stabile Form kristallisiert in einem trigonalen Kristallgitter und wird durch eine Kristallisation aus Lösungen in organischen Lösungsmitteln wie Ethylacetat gewonnen.[14] Die in einem orthorhombischen Gitter kristallisierende metastabile Form resultiert aus einer Kristallisation aus der Schmelze.[14] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,3711, B = 2413,323 und C = −45.444 im Temperaturbereich von 338 bis 495 K.[15] Die mittlere molare Verdampfungsenthalpie beträgt in diesem Temperaturbereich 60,9 kJ·mol−1.[15] Flüssiges Acetamid kann Säure-Base-Reaktionen eingehen. Hier kann ein Autoprotolysegleichgewicht formuliert werden. Bei 94 °C beträgt der pKa-Wert 10,49.[14]
Es zersetzt sich oberhalb von 220 °C in die Hauptprodukte Essigsäure, Ammoniak und Acetonitril, wobei Wasser und nitrose Gase als Nebenprodukte auftreten können.[14][6]
Verwendung
Es dient hauptsächlich als Lösungsmittel, da sich in ihm (im geschmolzenen Zustand) viele Substanzen gut lösen.[6] Außerdem findet es Anwendung in der Herstellung von Methylamin. Weiterhin wird es als Weichmacherzusatz in der Leder-, Tuch- und Papierindustrie sowie als Vulkanisationsbeschleuniger für synthetischen Kautschuk eingesetzt.[6][16] Der stabile 1:1-Komplex mit Bromwasserstoff wird für die Bromierung säureempfindlicher Stoffe verwendet.[6]
Biologische Bedeutung
Die Kristalle sind brennbar. Beim Verbrennen bilden sich toxische Dämpfe (Stickoxide). Der Stoff reagiert mit Säuren und starken Oxidationsmitteln.
Der Stoff wird inhalativ aufgenommen und reizt die Haut bzw. Augen. Eine Einwirkung von Acetamid ist an Rötungen und Schmerzen zu erkennen. Bei Tierversuchen traten Geburtsschäden auf. Es besteht der Verdacht, dass Acetamid beim Menschen krebserzeugend ist.
Acetamid als Mineral

Acetamid konnte 1974 als natürliches Bildungsprodukt in der Kohlegrube bei Tscherwonohrad in der Ukraine gefunden werden. Es wurde daher von der International Mineralogical Association (IMA) als eigenständiges Mineral anerkannt (interne Register-Nr. IMA1974-039). Diese führt es gemäß der Systematik der Minerale nach Strunz (9. Auflage) als Salz organischer Säuren in der Mineralklasse der „Organischen Verbindungen“ unter der System-Nr. „10.AA.20“.[17] Die Einstufung als Salz organischer Säuren entspricht allerdings nicht der chemischen Zusammensetzung, da Acetamid ein ungeladenes Molekül ist. Die im englischsprachigen Raum ebenfalls geläufige Systematik der Minerale nach Dana führt das Mineral unter der System-Nr. „50.04.07.01“ (Unterabteilung: Salze organischer Säuren mit verschiedenen Formeln).
Acetamid kristallisiert im trigonalen Kristallsystem mit der kristallchemischen Zusammensetzung CH3CONH2,[1] hat eine Mohshärte von 1 bis 1,5 und entwickelt überwiegend farblose, prismatische Kristalle bis etwa fünf Millimeter Länge und glas- bis fettglänzenden Oberflächen, aber auch Stalaktiten und körnige Mineral-Aggregate.
Es kommt jedoch auch in einer metastabilen Form mit einer orthorhombischen Kristallstruktur mit der Raumgruppe Pccn (Raumgruppen-Nr. 56) vor.[18]
Acetamid bildet sich bei einer Temperatur zwischen 50 °C und 150 °C in ammoniakreichen Bereichen brennender Kohlehalden (Kohlebrand). Aufgrund seiner Flüchtigkeit und Löslichkeit ist das Mineral nicht beständig und kann daher nur bei trockenem Wetter gefunden werden.[19]
Bisher ist nur die Typlokalität Tscherwonohrad als Fundort für Acetamid bekannt.[20]
Literatur
- B. I. Srebrodol'skii: Acetamide – a new mineral. In: Zapiski Vserossiyskogo Mineralogicheskogo Obshchestva. (1975): 104(3), S. 326–328; In: American Mineralogist. (1976): 61, S. 338.
- M. Windholz, S. Budavari, R.F. Blumetti, E.S. Otterbein (Hrsg.): The Merck Index. 10. Auflage. Merck & Co., Rahway (NJ, USA) 1983.
- B. I. Srebrodol'skii: Phases of mineral formation on spoil heaps of coal mines. Doklady Acad. Nauk SSSR: 290 (1986): 1730174.
- Frederic Senti, David Harker: The Crystal Structure of Rhombohedral Acetamide. In: J. Am. Chem. Soc., 62 (8), 1940, S. 2008–2019;
doi:
 10.1021/ja01865a029.
10.1021/ja01865a029. - W. A. Denne, R. W. H. Small: A Refinement of the Structure of Rhombohedral Acetamide. In: Acta Crystallographica, B27, 1971, S. 1094–1098;
doi:
 10.1107/S0567740871003583.
10.1107/S0567740871003583.
Einzelnachweise
- ↑ Hochspringen nach: a b c d Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 717.
- ↑ Hochspringen nach: a b
c d e
f g h
i j Eintrag zu
 Acetamid in der
GESTIS-Stoffdatenbank des
IFA. (JavaScript erforderlich)
Acetamid in der
GESTIS-Stoffdatenbank des
IFA. (JavaScript erforderlich)
- ↑ Günther Höhne, W. Hemminger, H.-J. Flammersheim: Differential Scanning Calorimetry. Springer Science & Business Media, 2003, ISBN 978-3-540-00467-7, S. 224.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ Frederick G. Bordwell: Equilibrium acidities in dimethyl sulfoxide
solution. In: Accounts of Chemical Research.
Band 21, 1988,
S. 456–463,
doi:
 10.1021/ar00156a004.
10.1021/ar00156a004.
- ↑ Hochspringen nach: a b c d e f g Eintrag zu Acetamid. In: Römpp Online. Georg Thieme Verlag,.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-4.
- ↑ Eintrag zu
 Acetamide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Acetamide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung  erweitern.
erweitern.
- ↑ Hochspringen nach: a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ Hochspringen nach: a
b C. Le Berre, P. Serp, P. Kalck, G.P. Torrence: Acetic Acid. In:
Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013;
doi:
 10.1002/14356007.a01_045.pub3.
10.1002/14356007.a01_045.pub3.
- ↑ S. Hauptmann, J. Graefe, H. Remane: Lehrbuch der organischen Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S.382.
- ↑ Hochspringen nach: a b
Emons, H.H.; Naumann, R.; Jahn, K.; Flammersheim, H.J.: Thermal properties of acetamide in the temperature range from 298 K to 400 K. In:
Thermochim. Acta 104 (1986) 127–137,
doi:
 10.1016/0040-6031(86)85191-7.
10.1016/0040-6031(86)85191-7.
- ↑ Hochspringen nach: a b
c d Kerridge, D.H.: The chemistry of molten acetamide and acetamide complexes. In:
Chem. Soc. Rev. 17 (1988) 181–227,
doi:
 10.1039/CS9881700181.
10.1039/CS9881700181.
- ↑ Hochspringen nach: a b Stull, D.R.:
Vapor Pressure of Pure Substances. Organic and Inorganic Compounds. In: Ind. Eng. Chem. 39 (1947) 517–540,
doi:
 10.1021/ie50448a022.
10.1021/ie50448a022.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S.144.
- ↑ Ernest H. Nickel, Monte C. Nichols:
 IMA/CNMNC List of Minerals 2009. (PDF, 1703 kB) In:
cnmnc.main.jp. IMA/CNMNC, Januar 2009, (englisch).
IMA/CNMNC List of Minerals 2009. (PDF, 1703 kB) In:
cnmnc.main.jp. IMA/CNMNC, Januar 2009, (englisch).
- ↑ W. C. Hamilton: The crystal structure of
orthorhombic acetamide. In: Acta Crystallographica. 18, S. 866,
doi:
 10.1107/S0365110X65002128.
10.1107/S0365110X65002128.
- ↑
 Acetamid. (PDF; 66 kB) In: Handbook of Mineralogy.
Acetamid. (PDF; 66 kB) In: Handbook of Mineralogy.
- ↑ Mindat:
 Acetamide (englisch).
Acetamide (englisch).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.12. 2024
