Formamid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR) | ||||||
| MAK | Schweiz: 10 ml/m3 bzw. 18 mg/m3 | ||||||
| Toxikologische Daten | |||||||
Formamid ist das Amid der Ameisensäure und das einfachste Carbonsäureamid.
| Strukturformel | |
|---|---|
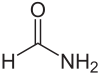 | |
| Allgemeines | |
| Name | Formamid |
| Andere Namen |
|
| Summenformel | CH3NO |
| Kurzbeschreibung | farblose bis gelbliche Flüssigkeit mit ammoniakartigem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 75-12-7 |
| EG-Nummer | 200-842-0 |
| ECHA-InfoCard | 100.000.766 |
| PubChem | 713 |
| Eigenschaften | |
| Molare Masse | 45,04 g/mol−1 |
| Aggregatzustand | flüssig |
| Dichte | 1,13 g/cm3 (20 °C) |
| Schmelzpunkt | 2 °C |
| Siedepunkt | 210 °C |
| Dampfdruck | 0,08 hPa (20 °C) |
| Löslichkeit | vollständig mischbar mit Wasser |
| Brechungsindex | 1,4472 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −254,0 kJ/mol |
Herstellung
Großtechnisch wird Formamid durch Umsetzung von Kohlenmonoxid mit Ammoniak hergestellt. Hierbei reagiert zunächst das Kohlenmonoxid mit Methanol zu Ameisensäuremethylester. Dieses wird anschließend mit Ammoniak umgesetzt, wobei das freiwerdende Methanol zur ersten Reaktionsstufe zurückgeführt wird.
Formamid kann in kleinen Mengen bei der Produktion von Amphetamin anfallen.
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur liegt die Substanz als farb- und geruchlose Flüssigkeit vor. Sie ist hygroskopisch und wirkt als Löse- und Reduktionsmittel.
Chemische Eigenschaften
Formamid ist bei Temperaturen oberhalb 185 °C instabil. Bei 185 °C spaltet es rein thermisch (ohne Katalysatoren) in Kohlenmonoxid, Kohlendioxid und Ammoniak, ohne dass Blausäure nachgewiesen wird. Bei 220 °C ist die Bildung von Ammoniak verstärkt, während sich Blausäure ebenfalls bildet. Mit zunehmender Temperatur nimmt die Bildung von Ammoniumcarbonat, Ammoniumhydrogencarbonat und Ammoniumcarbamat zu, wobei Letzteres besonders leicht aus wasserfreiem Ammoniak mit Kohlendioxid gebildet wird. Bei längerer thermischer Belastung bildet sich ein schwarzer, unlöslicher Feststoff, der identisch mit polymerer Blausäure ist und aus dem Purin isoliert werden konnte. Dieses Polymer (Rückstand) bildet ab 360 °C ebenfalls Blausäure sowie Isocyansäure. Außerdem bildet sich aus Formamid Isocyanursäure durch thermische Belastung.
Zur Herstellung von Blausäure aus Formamid durch Abspaltung von Wasser werden Katalysatoren verwendet, die die erwünschte Reaktion beschleunigen, während die thermische Spaltung, die zu unerwünschten Produkten führt, verdrängt wird. Hierfür sind geheizte Metalloberflächen – aus Messing oder Eisen – geeignet, die mit einer Metalloxidschicht, etwa aus Zink-, Aluminium-, Magnesium-, Chrom- oder Zinnoxiden überzogen sind, oder auch gesinterte Formkörper aus Aluminiumoxid und Siliciumdioxid oder solche aus Chrom-Nickel-Edelstahl. Ab Temperaturen zwischen 300 und 600 °C und bei Verwendung von gasförmigem Formamid eignen sich auch dehydrierende Metallkatalysatoren aus Stahl (Basis: Eisen mit Anteilen von Chrom und Nickel, geeignete Stahlqualitäten sind unter anderem 1.4541, 1.4571, 1.4573, 1.4580, 1.4401, 1.4404, 1.4435, 2.4816, 1.3401, 1.4876, 1.4762) mit großer innerer Oberfläche für die katalytische Umsetzung und zeigen dabei hohe Selektivitäten und Umsätze (> 90 %) bei Standzeiten von 500 bis 8000 Stunden.
Vorkommen
Formamid ist das einfachste Amid und überall (ubiquitär) im Universum vorhanden. Es wurde in den Kometen Hale-Bopp und Hyakutake sowie im galaktischen Zentrum von Sagittarius A* und generell in der interstellaren Materie nachgewiesen.
Verwendung
Formamid wird hauptsächlich durch Reaktion mit Schwefelsäure zur industriellen Synthese von Ameisensäure und Ammoniumsulfat verwendet. Weiterhin wird es in der Formamid-Vakuum-Synthese durch Pyrolyse zu Cyanwasserstoff verarbeitet. Es wird zudem als Zwischenprodukt für die Herstellung von Arzneistoffen und Fungiziden, etwa von Theophyllin oder Theobromin oder als Katalysator in Carbonylierungs-Reaktionen eingesetzt.
Formamid ist ein häufig verwendetes Lösungsmittel, etwa für Lacke, bestimmte Polymere und Beize sowie Tinte in Filzstiften.
Wichtigster Produzent für Formamid ist die BASF mit einer Produktionskapazität von 100.000 Tonnen pro Jahr (Stand 1998), der Großteil des produzierten Formamides wird direkt am Ort der Herstellung weiterverarbeitet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.06. 2025
