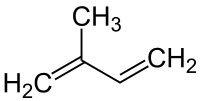
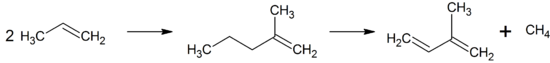Isopren
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | Schweiz: 3 ml/m3 bzw. 8,5 mg/m3 | |||||||
Isopren ist der Trivialname für den ungesättigten Kohlenwasserstoff 2-Methylbuta-1,3-dien. Es ist ein Derivat des 1,3-Butadiens. Isopren ist die Grundeinheit der Terpene, wird selbst aber meist nicht zu diesen gezählt. Isopren wird von vielen Pflanzen produziert und in die Erdatmosphäre abgegeben. Es ist neben Methan der Kohlenwasserstoff mit der höchsten Emissionsrate.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Isopren |
| Andere Namen |
2-Methylbuta-1,3-dien |
| Summenformel | C5H8 |
| Kurzbeschreibung | farblose, hochentzündliche Flüssigkeit mit mildem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 78-79-5 |
| EG-Nummer | 201-143-3 |
| ECHA-InfoCard | 100.001.040 |
| PubChem | 6557 |
| Eigenschaften | |
| Molare Masse | 68,12 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 0,68 g/cm3 |
| Schmelzpunkt | −146 °C |
| Siedepunkt | 34 °C |
| Dampfdruck | 604 hPa (20 °C) |
| Löslichkeit |
|
| Brechungsindex | 1,4218 |
Geschichte
1860 isolierte Charles Hanson Greville Williams durch Destillation die Zersetzungsprodukte des Naturkautschuks und nannte das leichteste „Isopren“. Die Strukturformel stammte von William A. Tilden (1882), der auch Isopren in Terpentinöl fand. Korrekte Vorstellungen vom Aufbau von Naturkautschuk aus Isopren hatte Hermann Staudinger (1920), wobei er in Samuel Pickles (1906) einen Vorläufer hatte.
Synthese
Es gibt eine Vielzahl von Synthesen für Isopren. Ethen reagiert mit Propen zu 2-Methylbuten. 2-Methylbuten wird an Chromoxid-Aluminiumoxid-Katalysatoren zum Isopren dehydriert.
Eine weitere Möglichkeit ist die Dimerisierung von Propen zu 2-Methylpenten und die nachfolgende Abspaltung von Methan:
Weitere Synthesen sind z. B. die Thermolyse von Terpentin (in der Isoprenlampe nach C. H. Arries) oder die Pyrolyse von Dipenten oder Limonen. Die am häufigsten verwendete Synthese ist die säurekatalysierte Additionsreaktion von Formaldehyd an Isobuten über die Prins-Reaktion, bei der 1,3-Dioxan entsteht, das in der Gasphase bei 200 bis 300 °C über einem Säurekatalysator wie Phosphorsäure zu Isopren gespalten wird. Eine weitere Synthese ausgehend von Isobuten und Formaldehyd erzeugt 2-Methyl-1-buten-4-ol, das bei 100 °C in einer Lösung aus Salzsäure und Natriumchlorid dehydatisiert wird. Ebenso kann Isopren aus 2-Methylbutanal erzeugt werden, das durch Rhodium-katalysierte Hydroformylierung von 2-Buten und anschließende Dehydratisierung erzeugt wird.
Bedeutung und Vorkommen
Isoprenproduktion durch Pflanzen
Vom Isopren lassen sich formal viele Naturstoffe ableiten, die zu den isoprenoiden Naturstoffen zusammengefasst werden. Ein Beispiel hierfür sind die Steroide und Terpene. Der direkte Vorläufer und Ausgangspunkt der Biosynthese der Isoprenoide ist jedoch nicht Isopren, sondern das biochemisch aktivierte Isopentenyl-Pyrophosphat (IPP) und dessen Isomer Dimethylallyl-Pyrophosphat (DMAPP). Isopren selbst wird von vielen Bäumen und Phytoplankton produziert; der Grund dafür ist aber nicht geklärt. Gemäß einer Hypothese soll das gasförmige Isopren die Pflanzen vor Oxidation durch bodennahes Ozon schützen.
Eine Pflanze, deren freigesetztes Isopren bei Windstille an heißen Tagen angezündet werden kann, ist Diptam (Dictamnus sp.) (englisch: gas plant). Die Pflanze nimmt dabei keinen Schaden.
Isopren kommt verknüpft in wiederholenden Einheiten in Membranen der Archaea vor. Dort bilden sie die hydrophoben Anteile der Lipide und sind über Etherbindungen mit Glycerinmolekülen verknüpft. Die Isopreneinheiten der äußeren und inneren Schicht können sich verbinden, sodass eine einlagige Lipidschicht entsteht.
>Isopren in der Atmosphäre
Isopren wird von Pflanzen in die Atmosphäre abgegeben. Die jährliche Emission beträgt etwa 600 Megatonnen, die Hälfte davon stammt aus tropischen Bäumen. Das entspricht etwa den jährlichen Methanemissionen. Isopren wird durch die Reaktion mit OH-Radikalen und Ozon abgebaut, dabei entstehen Aldehyde, Peroxide und organische Nitrate, die sich in Tröpfchen lösen oder Partikel bilden können.
Verwendung
Zur Herstellung von Isopren-Kautschuk (IR), daneben auch für Naturstoffsynthesen, z.;B. für α-Terpineol.
Sicherheitshinweise und Toxikologie
Isopren ist nur von geringer akuter Toxizität: Der orale LD50-Wert für Ratten ist > 2000 mg/kg. Isopren kann inhalativ und durch Verschlucken aufgenommen werden. Der Kontakt mit Augen und Haut erzeugt Rötungen und Schmerz, eine Inhalation ruft Husten, Übelkeit, Brennen und flachen Atem hervor. Im Tierversuch wirkt Isopren krebserregend und erbgutverändernd.
Reaktionen
- Isopren dimerisiert im Sinne einer Diels-Alder-Reaktion beim Erhitzen zu Limonen; die Reaktion gelang erstmals Gustave Bouchardat im Jahr 1878.
- Isopren wird mit Acrylsäuremethylester in einer Diels-Alder-Reaktion zu racemischem 4-Methylcyclohex-3-en-1-carbonsäuremethylester umgesetzt. Dieser ergibt in einer Grignard-Reaktion mit Methylmagnesiumbromid (CH3MgBr, Grignard-Reagenz) nach der Hydrolyse α-Terpineol als Racemat:
-
-Terpinol_Synthesis_V.1.png) Synthese von (±)-α-Terpineol [(RS)-α-Terpineol].
Synthese von (±)-α-Terpineol [(RS)-α-Terpineol].


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.12. 2024