
Dehydrierung
Dehydrierung bezeichnet die Abspaltung von Wasserstoff aus einer chemischen Verbindung. Es handelt sich um die Umkehrreaktion zur Hydrierung. Dehydrierungen finden sowohl in biochemischen Prozessen wie auch in chemisch-technischen Prozessen statt.
Typen von Dehydrierungen
Die Abspaltung von Wasserstoff kann unter Freisetzung von molekularem Wasserstoff erfolgen, oft wird der Wasserstoff jedoch auf andere chemische Verbindungen übertragen (Transferhydrierung) oder von oxidierenden Akzeptoren gebunden. Findet eine Dehydrierung in Gegenwart von Enzymen oder metallischen oder oxidischen Katalysatoren statt, wird jeweils ein Wasserstoffmolekül in einer Eliminierungsreaktion abgespalten. Sauerstoff-Radikale, Chinone, Schwefel oder Selen führen dagegen zur Abspaltung einzelner Wasserstoff-Atome (univalente Dehydrierung).
Enzymatische Dehydrierung

Die Enzyme, welche Dehydrierungen in der Biochemie ermöglichen, heißen Dehydrogenasen. Ein wichtiges Coenzym solcher Dehydrogenasen ist NAD+, welches als Wasserstoffakzeptor wirkt und dabei zu NADH reduziert wird.
Technische Dehydrierungen
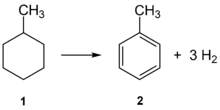
Die Dehydrierung ist eine wichtige Reaktion in der chemischen Verfahrenstechnik. Meist wird dabei aus den jeweiligen Substraten molekularer Wasserstoff abgespalten. Um diesen eigentlich endothermen Prozess in die gewünschte Richtung zu lenken, wird die Dehydrierung oft in Gegenwart von Sauerstoff durchgeführt, der mit dem abgespaltenen Wasserstoff zu Wasser reagiert; dadurch wird die Gesamtreaktion exotherm.
Beispiele für technisch durchgeführte Dehydrierungen:
Die letztgenannte Reaktion findet großtechnisch auch als Teilreaktion des katalytischen Reformings in Erdölraffinerien statt.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.11. 2024