
Butene
Butene (auch Butylene) sind eine Gruppe von vier isomeren Kohlenwasserstoffen mit der allgemeinen Summenformel C4H8, die über eine C=C-Doppelbindung verfügen. Sie zählen damit zu den Alkenen. Zwei der Isomere unterscheiden sich durch cis-trans-Isomerie.
Butene sind unter Standardbedingungen farblose, brennbare Gase mit einer größeren Dichte als Luft. Unter Druck lassen sich die Isomere verflüssigen. Sie wirken in höheren Konzentrationen narkotisierend und erstickend. Mit Luft bilden sie explosive Gemische.
Struktur und Eigenschaften
| Eigenschaften der Butene | ||||||||||||
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en | ||||||||
| Andere Namen | 1-Buten n-Buten 1-Butylen α-Butylen |
cis-2-Buten (Z)-2-Buten cis-But-2-en |
trans-2-Buten (E)-2-Buten trans-But-2-en |
2-Methyl-1-propen Isobuten i-Butylen | ||||||||
| Struktur | 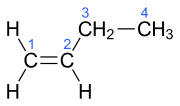 |
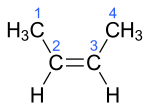 |
 |
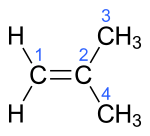 | ||||||||
| CAS-Nummer | 106-98-9 | 590-18-1 | 624-64-6 | 115-11-7 | ||||||||
| CAS-Nummer Isomerengemisch | 25167-67-3 | |||||||||||
| Summenformel | C4H8 | |||||||||||
| Molare Masse | 56,11 g/mol | |||||||||||
| Kurzbeschreibung | farblose Gase | |||||||||||
| Schmelzpunkt | −185,4 °C | −138,9 °C | −105,5 °C | −140,4 °C | ||||||||
| Siedepunkt | −6,2 °C | 3,7 °C | 0,9 °C | −7,1 °C | ||||||||
| Verdampfungswärme am Siedepunkt | 22,07 kJ/mol | 23,34 kJ/mol | 22,72 kJ/mol | 24,03 kJ/mol | ||||||||
| Dampfdruck | 2,545 bar (20 °C) | 1,813 bar (20 °C) | 1,991 bar (20 °C) | 2,59 bar (20 °C) | ||||||||
| Untere Explosionsgrenze (20 °C / 1,013 bar) | 1,2 Vol.‑% / 28 g·m3 | 1,6 Vol.‑% / 37 g·m3 | 1,6 Vol.‑% / 37 g·m3 | 1,6 Vol.‑% / 37 g·m3 | ||||||||
| Obere Explosionsgrenze (20 °C / 1,013 bar) | 10,6 Vol.‑% / 252 g·m3 | 10,0 Vol.‑% / 235 g·m3 | 10,0 Vol.‑% / 235 g·m3 | 10,0 Vol.‑% / 235 g·m3 | ||||||||
| Zündtemperatur / Temperaturklasse | 360 °C / T2 | n.b | n.b | 465 °C / T1 | ||||||||
| Löslichkeit | praktisch unlöslich in Wasser, leichtlöslich in Ethanol und Ether | |||||||||||
| GHS- Kennzeichnung |
aus Verordnung (EG)
Nr. 1272/2008 (CLP),
ggf. erweitert
|
aus Verordnung (EG)
Nr. 1272/2008 (CLP),
ggf. erweitert
|
aus Verordnung (EG)
Nr. 1272/2008 (CLP),
ggf. erweitert
|
aus Verordnung (EG)
Nr. 1272/2008 (CLP),
ggf. erweitert
| ||||||||
| H-Sätze | Extrem entzündbares Gas. Enthält Gas unter Druck; kann bei Erwärmung explodieren. |
Extrem entzündbares Gas. | Extrem entzündbares Gas. | Extrem entzündbares Gas. Enthält Gas unter Druck; kann bei Erwärmung explodieren. | ||||||||
| EUH-Sätze | keine EUH-Sätze | |||||||||||
| P-Sätze | Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen. Brand von ausströmendem Gas: Nicht löschen, bis Undichtigkeit gefahrlos beseitigt werden kann. Bei Undichtigkeit alle Zündquellen entfernen. An einem gut belüfteten Ort aufbewahren. |
Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen. | Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen. | Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen. Brand von ausströmendem Gas: Nicht löschen, bis Undichtigkeit gefahrlos beseitigt werden kann. Bei Undichtigkeit alle Zündquellen entfernen An einem gut belüfteten Ort aufbewahren. | ||||||||
Thermodynamische Eigenschaften
Butene sind leicht zu verflüssigende Gase, deren Anwendung und Umsetzung oft unter erhöhtem Druck als Flüssigkeit oder im überkritischen Zustand erfolgt.
| Dampf-Flüssig-Gleichgewichte | ||||
|---|---|---|---|---|
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en |
| Dampfdruckfunktion nach Antoine | Parameter nach log10(P) = A−(B/(T+C)) (P in bar, T in K) | |||
| A | 4,24696 | 3,98744 | 4,04360 | 3,64709 |
| B | 1099,207 | 957,060 | 982,166 | 799,055 |
| C | −8,265 | −36,504 | −30,775 | −46,615 |
| Temperaturbereich | 195,6 K – 269,4 K | 203,06 K – 295,91 K | 201,70 K – 274,13 K | 216,40 K – 273 K |
| Kritische Größen | ||||
|---|---|---|---|---|
| Name | But-1-en | (Z)-But-2-en | (E)-But-2-en | 2-Methylprop-1-en |
| Kritische Temperatur Tc | 146,35 °C / 419,5 K | 162,35 °C / 435,5 K | 155,45 °C / 428,6 K | 144,75 °C / 417,9 K |
| Kritischer Druck pc | 40,2 bar | 42,1 bar | 41,0 bar | 40,0 bar |
| Kritisches Molvolumen Vm,c | 0,2408 l·mol−1 | 0,2338 l·mol−1 | 0,2377 l·mol−1 | 0,2388 l·mol−1 |
| Kritische Dichte ρc | 4,15 mol·l−1 | 4,28 mol·l−1 | 4,21 mol·l−1 | 4,19 mol·l−1 |
Synthese
Michael Faraday fand Butene 1825 als gasförmigen Bestandteil bei der Destillation von Erdöl. Butene können durch Cracken von Erdöl als Isomerengemisch gewonnen werden. Sie werden auch durch thermische Reaktion (Dehydrierung) von n-Butan bzw. Isobutan gewonnen.
Verwendung
Durch die C-C-Doppelbindung sind sie interessante und wichtige Ausgangsstoffe für chemische Synthesen. Sie werden zur Herstellung von Verbindungen wie 2-Butanol, 2-Butanon (durch Oxo-Synthese) und 1,3-Butadien verwendet und sind Ausgangsstoff zur Herstellung von Kunststoffen (z.B. Butylkautschuk und Polyisobuten). Als Alkylierungsmittel dienen sie z.B. zur Synthese von Zusätzen für klopffeste Treibstoffe (2,2,4-Trimethylpentan (Isooctan)). Isobuten wird zur Synthese von Methyl-tert-butylether (MTBE) bzw. Ethyl-tert-butylether (ETBE) benötigt. Auch tert-Butylester lassen sich über die Reaktion von Isobuten und (Carbon)säuren herstellen. Diese Syntheseroute bietet sich speziell dann an, wenn bei der Veresterung mit tert-Butanol als Konkurrenzreaktion dessen Dehydratisierung dominiert.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 18.08. 2025

