
Isobutan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | 1000 ml/m3[3] | |||||||
Isobutan (systematischer Name nach IUPAC: 2-Methylpropan) ist eine organische chemische Verbindung aus der Gruppe der Alkane. Es ist ein Konstitutionsisomer des Butans und der einfachste verzweigte Kohlenwasserstoff.
| Strukturformel | ||
|---|---|---|
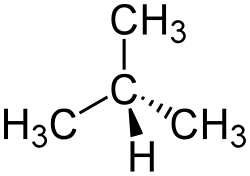 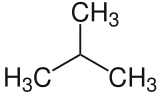
| ||
| Keilstrichformel (oben) und Skelettformel | ||
| Allgemeines | ||
| Name | Isobutan | |
| Andere Namen | ||
| Summenformel | C4H10 | |
| Kurzbeschreibung | farbloses Gas mit süßlichem Geruch[3] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 200-857-2 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse | 58,12 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte | 2,70 kg/m3 (bei 0 °C, 1013 hPa) 0,5937 kg/l1 flüssig unter Druck[3] | |
| Schmelzpunkt | −159,42 °C[3] | |
| Siedepunkt | −11,7 °C[3] | |
| Dampfdruck | 301,9 kPa (20 °C)[3] | |
| Löslichkeit |
| |
| Dipolmoment | ||
| Brechungsindex | 1,3518 (−25 °C)[6] | |
Vorkommen
Isobutan kommt in Erdgasen und Erdölen vor und wird hauptsächlich in Erdölraffinerien gewonnen. Isobutan kommt in der Natur wesentlich seltener vor als n-Butan.
Eigenschaften
Isobutan ist ein farbloses, fast geruchloses, brennbares Gas. Es ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend und erstickend. Der Flammpunkt liegt bei −83 °C, die Zündtemperatur bei 460 °C.[3] Der Stoff fällt somit in die Temperaturklasse T1. Für Isobutan liegt die untere Explosionsgrenze (UEG) bei 1,5 Vol.-% (37 g/m3) und die obere Explosionsgrenze (OEG) bei 9,4 Vol.-% (231 g/m3).[3] Diese Werte unterscheiden sich kaum von den Werten für das strukturisomere n-Butan. Die Sauerstoffgrenzkonzentration liegt bei 10,3 Vol.-%.[3]
Verwendung
Isobutan ist ein Grundstoff in der chemischen Industrie. Große Mengen werden zur Herstellung von Alkylat (Alkylierung, Isooktan) verwendet. Einige andere Chemikalien, wie Isobuten und tert-Butylhydroperoxid[3] werden aus Isobutan hergestellt. Zusammen mit Butan wird das Treibgas in Sprühdosen als Lebensmittelzusatzstoff E 943b eingesetzt.[8] Da es wie andere Alkane brennbar ist, wird es als Brennstoff benutzt. Isobutan wird auch als Beimischung für Campinggas verwendet. Da Isobutan einen niedrigeren Siedepunkt als n-Butan (−0,5 °C) aufweist, wird Campinggas aus Propan und Isobutan gemischt. Dadurch eignet sich dieses Gasgemisch nicht nur für den Sommer, sondern auch für den Einsatz im Winter und auf Hochtouren.
Kältemittel
Isobutan weist ein sehr niedriges Treibhauspotenzial auf (GWP 3) und wird deswegen in Kühlschränken und Klimaanlagen als Kältemittel mit der Bezeichnung R-600a eingesetzt. Die Einsatzgrenze liegt aus Sicherheitsgründen derzeit bei 150 g pro Gerät. Seit 1992 Greenpeace das Projekt Greenfreeze mit Hilfe der ehemaligen Firma Foron vorgestellt hat, wird R-600a in Kühlschränken verwendet.[9] In Europa hat R-600a das zuvor als Kältemittel in Haushaltsgeräten verwendete R-134a fast vollständig verdrängt, da R-600a billiger ist, ein wesentlich niedrigeres Treibhauspotenzial hat, weniger chemische Verträglichkeitsprobleme hat und mit Mineralöl mischbar ist. Die meisten Geräte kommen mit weniger als 50 g Kältemittel aus. Bis 2011 sind schon 300 Millionen Geräte auf den Markt gekommen.
Auch manche Solarkollektoren verwenden Isobutan als Wärmeträger.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu
 E 943b: Isobutane in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 26. Juli 2025.
E 943b: Isobutane in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 26. Juli 2025.
- ↑ Eintrag zu
 ISOBUTANE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Juli 2025.
ISOBUTANE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Juli 2025.
- ↑ Hochspringen nach: a b c d
e f g h i
j k l m
Eintrag zu
 Isobutan in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 26. Juli 2025. (JavaScript erforderlich)
Isobutan in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 26. Juli 2025. (JavaScript erforderlich)
- ↑ Eintrag zu
 Butane. In:
Römpp Online. Georg Thieme Verlag.
Butane. In:
Römpp Online. Georg Thieme Verlag.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-308.
- ↑ Eintrag zu Isobutane in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA),
abgerufen am 26. Juli 2025. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑
 Verordnung (EG) Nr. 1333/2008
in der konsolidierten Fassung vom 31. Oktober 2022
Verordnung (EG) Nr. 1333/2008
in der konsolidierten Fassung vom 31. Oktober 2022
- ↑ greenpeace.de:
 Greenfreeze:
Der FCKW-freie Kühlschrank.
Greenfreeze:
Der FCKW-freie Kühlschrank.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025

