
Cyclohexanon
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | |||||||||
Cyclohexanon ist im reinen Zustand eine farblose, wasserklare Flüssigkeit, deren Geruch ein wenig an Aceton erinnert. Es gehört zur Gruppe der zyklischen Ketone (Cycloalkanone).
| Strukturformel | ||
|---|---|---|
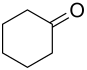
| ||
| Allgemeines | ||
| Name | Cyclohexanon | |
| Andere Namen | ||
| Summenformel | C6H10O | |
| Kurzbeschreibung | farblose Flüssigkeit mit pfefferminzartigem Geruch[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 108-94-1 | |
| EG-Nummer | 203-631-1 | |
| ECHA-InfoCard | 100.003.302 | |
| PubChem | 7967 | |
| DrugBank | DB02060 | |
| Eigenschaften | ||
| Molare Masse | 98,15 g/mol | |
| Aggregatzustand | flüssig[2] | |
| Dichte | 0,95 g/cm3 (20 °C)[2] | |
| Schmelzpunkt | −26 °C[2] | |
| Siedepunkt | 156 °C[2] | |
| Dampfdruck | ||
| Löslichkeit |
| |
| Brechungsindex | 1,4507 (20 °C)[4] | |
Gewinnung und Darstellung
Zur technischen Synthese von Cyclohexanon stehen hauptsächlich zwei Verfahren zur Verfügung:
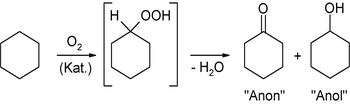
1) Die katalytische Oxidation von Cyclohexan mit Luftsauerstoff, die über das instabile Cyclohexylhydroperoxid verläuft und einem radikalischen Mechanismus folgt. Dabei wird ein Gemisch aus Cyclohexanon und Cyclohexanol gebildet, welche man auch abgekürzt als Anon und Anol bezeichnet. Das Gemisch kann destillativ aufgetrennt werden.
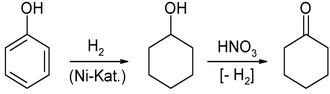
2) Die Oxidation von Cyclohexanol mit verdünnter Salpetersäure oder in der Gasphase an Zinkoxid-Katalysatoren. Das Cyclohexanol wird zuvor durch Hydrierung von Phenol an einem Nickel-Katalysator hergestellt:
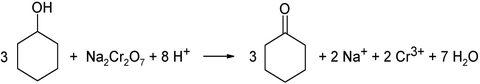
Im Labormaßstab kann Cyclohexanon auch durch Oxidation von Cyclohexanol in saurer Lösung mit Chrom(VI)-salzen, z. B. Natriumdichromat, erhalten werden. Diese Reaktion verläuft mechanistisch über einen Chromsäureester des Cyclohexanols:
Die enzymatische Doppeloxidation von Cyclohexan zu Cyclohexanon ist in der Literatur ebenfalls beschrieben.[7]
Eigenschaften
Physikalische Eigenschaften
Cyclohexanon ist bei Raumtemperatur eine farblose Flüssigkeit mit einer Dichte von 0,947 g/cm³. Es erstarrt bei −31 °C und siedet unter Normaldruck bei 155,6 °C.[8] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,1033, B = 1495,51 und C = −63,598 im Temperaturbereich von 362,78 bis 438,92 K.[9] Die Verdampfungswärme ΔVH beträgt am Siedepunkt 35,40 kJ/mol.[10] Es ist mit den meisten gängigen organischen Lösungsmitteln in jedem Verhältnis mischbar. Die Mischbarkeit mit Wasser ist begrenzt. Die Löslichkeiten betragen bei 20 °C 9,0 g Cyclohexanon in 100 g Wasser bzw. 5,7 g Wasser in 100 g Cyclohexanon.[11] Diese Löslichkeiten sind temperaturabhängig. Mit steigender Temperatur sinkt die Löslichkeit von Cyclohexanon in Wasser bzw. steigt die Löslichkeit von Wasser in Cyclohexanon.[12] Mit Wasser existiert ein konstant siedendes (azeotropes) Gemisch bei 96 °C und 57 % Wasseranteil.[13]
Löslichkeiten zwischen Cyclohexanon und Wasser[12] Temperatur °C 0 9,8 19,5 29,8 40,1 50,2 60,5 71,1 80,2 90,7 Cyclohexanon in Wasser in Ma% 13,7 11,5 9,7 8,2 7,5 7,0 6,7 6,5 6,8 6,9 Wasser in Cyclohexanon in Ma% 4,69 5,05 5,35 5,93 6,28 6,81 7,34 8,15 8,84 9,82
Chemische Eigenschaften
Cyclohexanon zeigt die für Ketone typischen Reaktionen, beispielsweise:
- Iminbildung mit Ammoniak und primären Aminen,
- Enaminbildung mit sekundären Aminen (s. u.),
- CH-Acidität der beiden CH2-Gruppen, die der Carbonylgruppe benachbart sind, und die damit verbundene Enolisierbarkeit,
- Aldolreaktionen unter Basen- oder Säurekatalyse,
- Reaktion mit Grignard-Reagenzien,
- Olefinbildung unter den Bedingungen der Wittig-Reaktion oder der Horner-Wadsworth-Emmons-Reaktion,
etc.
Mit Natriumborhydrid lässt es sich leicht zu Cyclohexanol
reduzieren.
Von konzentrierter Salpetersäure (65 %ig) wird es bei 30–40 °C unter Ringöffnung zu Adipinsäure
oxidiert. Zur Synthese der Adipinsäure geht man allerdings vom Cyclohexanol aus, wobei das zunächst nach der oben aufgeführten Reaktion gebildete Cyclohexanon sofort weiter reagiert.
Sicherheitstechnische Kenngrößen
Cyclohexanon bildet entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 43 °C.[2][14] Der Explosionsbereich liegt zwischen 1,3 Vol.‑% (53 g/m³) als untere Explosionsgrenze (UEG) und 9,4 Vol.‑% (380 g/m³) als obere Explosionsgrenze (OEG).[2][14] Der untere Explosionspunkt liegt bei 38 °C.[2] Die Grenzspaltweite wurde mit 0,95 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Sauerstoffgrenzkonzentration wurde mit 9,2 Mol.–% unter Stickstoff und 12,4 Mol.–% unter Kohlendioxid als Inertgas bestimmt.[15] Die Zündtemperatur beträgt 430 °C.[2][14] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
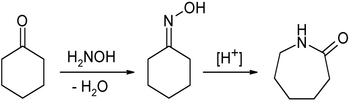
Die wohl wichtigste industrielle Verwendung von Cyclohexanon ist die Umsetzung zu ε-Caprolactam, welches zur Herstellung von Perlon dient. Zuerst wird durch Kondensation mit Hydroxylamin (in Form von Hydroxylaminhydrochlorid eingesetzt) das Cyclohexanonoxim gebildet, welches in einer Beckmann-Umlagerung zum ε-Caprolactam umgesetzt wird:
Besonders in Praktikumsversuchen in der chemischen Ausbildung dient es als typischer Vertreter der zyklischen Ketone. Beispielsweise gelingen die Bildung von Enaminen oder die α-Alkylierung mit Cyclohexanon als Ausgangsstoff sehr gut:
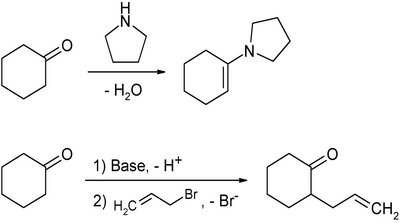
Aufgrund seiner vielfältigen Reaktionsmöglichkeiten als Keton wird es oft in der organischen Synthesechemie eingesetzt, wenn Sechsring-Strukturelemente in Molekülgerüste eingebaut werden sollen.
Weiterhin ist Cyclohexanon ein sehr gutes Lösungsmittel für Lackrohstoffe, Polyvinylchlorid, basische Farbstoffe sowie Natur- und Kunstharze. Auch in Deckfarben für Leder, Druckfarben und Abbeizmitteln ist der Stoff enthalten.[2]
Bei der Bestimmung von Zink mit Zincon wird Cyclohexanon als selektives Demaskierungsreagenz genutzt.
Sicherheitshinweise
Cyclohexanon ist besonders beim Einatmen gesundheitsschädlich und kann Schwindelanfälle und Kopfschmerzen hervorrufen. Weiterhin bildet es beim Erwärmen entzündliche Dämpfe. Daher sollte es unter einem gut ziehenden Abzug gehandhabt werden. Dabei sind Schutzhandschuhe und Schutzbrille zu tragen.
Risikobewertung
Cyclohexanon wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Cyclohexanon waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der möglichen Gefahren durch krebsauslösende, mutagene und reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2016 statt und wurde von Polen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[16][17]
Literatur
- Beyer/Walter: Lehrbuch der Organischen Chemie. Hirzel-Verlag Stuttgart, 23 Aufl. 1998, S. 306, 353 und 430
Einzelnachweise
- ↑ Eintrag zu
 CYCLOHEXANONE in der CosIng-Datenbank der EU-Kommission.
CYCLOHEXANONE in der CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
l m n
o p q
r s t Eintrag zu
 Cyclohexanon in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Cyclohexanon in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu Cyclohexanon. In: Römpp Online. Georg Thieme Verlag.
- ↑ Datenblatt
 Cyclohexanon
bei Thermo Fisher Scientific.
Cyclohexanon
bei Thermo Fisher Scientific.
- ↑ Eintrag zu
 Cyclohexanone im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Cyclohexanone im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 108-94-1 bzw. Cyclohexanon).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 108-94-1 bzw. Cyclohexanon).
- ↑ Svenja Staudt, Edyta Burda, Carolin Giese, Christina A. Mller, Jan Marienhagen, Ulrich Schwaneberg, Werner Hummel, Karlheinz Drauz und Harald Gröger: Direktoxidation von Cycloalkanen zu Cycloalkanonen mit Sauerstoff in Wasser. In: Angewandte Chemie 125 (2013) S. 2415–2419.
- ↑ Wolf, G.: Thermochemical studies of cyclic ketones in
Helv. Chim. Acta 55 (1972) 1446–1459,
doi:
 10.1002/hlca.19720550510.
10.1002/hlca.19720550510.
- ↑ Meyer, E.F.; Hotz, R.D.: High-precision vapor-pressure data for eight organic compounds in
J. Chem. Eng. Data 18 (1973) 359–362,
doi:
 10.1021/je60059a008.
10.1021/je60059a008.
- ↑ Svoboda, V.; Kubes, V.; Basarova, P.: Enthalpies of vaporization and cohesive energies of
hexan-2-one, 2-methylpentan-4-one, 2,2-dimethylbutan-3-one, 2,6-dimethylheptan-4-one and cyclohexanone in
J. Chem. Thermodyn. 24 (1992) 333–336,
doi:
 10.1016/S0021-9614(05)80074-6.
10.1016/S0021-9614(05)80074-6.
- ↑ M.T. Musser: Cyclohexanol and Cyclohexanone in Ullmann's Encyclopedia of Industrial
Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim,
doi:
 10.1002/14356007.a08_217.pub2.
10.1002/14356007.a08_217.pub2.
- ↑ Hochspringen nach: a b R.M. Stephenson:
Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95,
 doi:10.1021/je00005a024.
doi:10.1021/je00005a024.
- ↑ I.M. Smallwood: Handbook of organic solvent properties, Arnold London 1996, ISBN 0-340-64578-4, S. 183–185.
- ↑ Hochspringen nach: a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ S. Zakel, J. Förster, M. Mitu: Abschlussbericht zum PTB-Forschungsvorhaben 37064
Sauerstoffgrenzkonzentration von Alkoholen und Ketonen in Stickstoff und Kohlendioxid, PTB Braunschweig, Mai 2023
 pdf.
pdf.
- ↑ Europäische Chemikalienagentur
(ECHA):
 Substance Evaluation Conclusion and Evaluation Report.
Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP)
der Europäischen Chemikalienagentur (ECHA):
 Cyclohexanone.
Cyclohexanone.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.11. 2025


