
Campher
| Sicherheitshinweise | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| MAK |
| ||||||||||||
| Toxikologische Daten | |||||||||||||

Campher bzw. lateinisch Camphora (fachsprachlich, standardsprachlich Kampfer) ist ein durch Wasserdampfdestillation aus dem Holz von Kampferbäumen gewonnener farbloser, in Wasser kaum löslicher Feststoff. Er ist ein bicyclisches Monoterpen-Keton und leitet sich formal vom Bornan ab. Es gibt zwei Enantiomere des Camphers: (+)-Campher [Synonym: (1R,4R)-Campher] und (−)-Campher [Synonym: (1S,4S)-Campher]. Die Struktur wurde von Julius Bredt aufgeklärt.
Campher kommt in verschiedenen Gewächsen natürlich vor und wird industriell synthetisch hergestellt. Er ist arzneilich wirksam, in missbräuchlicher Dosierung psychoaktiv und toxisch. Er ist als Gefahrstoff geringerer Gefährlichkeit eingestuft und wird unter anderem als Bestandteil technischer und medizinischer Produkte eingesetzt.
Campher wird aus dem Holz, den Stümpfen, Zweigen und Blättern eines Kampferbaums destilliert. Bis ins 16. Jahrhundert nutzte man den Borneokampferbaum (Dryobalanops aromatica Gaertn., synonym Dryobalanops camphora), ab dem 16. Jahrhundert vor allem den Kampferbaum (Cinnamomum camphora, synonym: Laurus camphora und Camphora lauri). Seit der Spätantike (5. Jahrhundert) ist Kampfer (auch Campfer und lateinisch Camphora) unter dem griechischen Namen kaphurá (καφουρά) bekannt, der auf Sanskrit karpura (‚weiß‘) bzw. Prakrit kappura zurückgeht. Der indische Name wiederum entstand durch Entlehnung aus einer austronesischen Sprache Sumatras. Mittelhochdeutsch und frühneuhochdeutsch und bis ins 19. Jahrhundert hieß Kampfer (ab etwa 1250 von altfranzösisch camphre) bzw. das Harz vom Kampferbaum auch Gaffer, regional auch Gauffer.
| Strukturformel | |
|---|---|
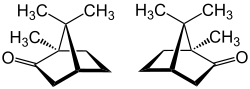 | |
| (+)-Campher (links) und (–)-Campher (rechts) | |
| Allgemeines | |
| Name | Campher |
| Andere Namen |
|
| Summenformel | C10H16O |
| Kurzbeschreibung | farbloser Feststoff mit aromatischem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 200-945-0 |
| ECHA-InfoCard | 100.000.860 |
| PubChem | 2537 |
| ChemSpider | 2441 |
| DrugBank | DB14156 |
| Arzneistoffangaben | |
| ATC-Code | C01EB02 |
| Eigenschaften | |
| Molare Masse | 152,23 g/mol |
| Aggregatzustand | fest |
| Dichte | 1 g/cm3 [(±)-Campher] |
| Schmelzpunkt | 179 °C [(±)-Campher] |
| Siedepunkt | 209 °C [(±)-Campher] |
| Löslichkeit | löslich in Wasser (1,5 g/l−1 bei 20 °C) |
Vorkommen
Beide Enantiomere des Camphers [(+)-Campher bzw. (−)-Campher] sowie das Racemat (±)-Campher kommen in der Natur vor. Campher findet sich hauptsächlich in den ätherischen Ölen von Lorbeergewächsen, Korbblütlern und Lippenblütlern. (+)-Campher kommt in der Rinde und im Harz des Kampferbaums (Cinnamomum camphora) vor, eines immergrünen Baums, der hauptsächlich in Asien wächst.
Eigenschaften
Campher ist ein farbloses oder weißes, meist krümeliges und brockig zähes Pulver aus wachsweichen Kristallen. Aus Ethanol kristallisiert er rhomboedrisch. Beim Abschrecken geschmolzenen Camphers bilden sich kubische Kristalle. Campher hat einen charakteristischen, starken, wohlriechenden, aromatisch-holzigen, eukalyptusartigen Geruch. Der Geschmack ist scharf und bitter, auch leicht kühlend wie bei Menthol. Er schmilzt bei 179 °C und siedet bei 209 °C. In Wasser ist das Pulver kaum löslich (1,5 g pro Liter Wasser); in Ethanol hingegen löst es sich gut. Außerdem ist es sehr leicht löslich in Petrolether, leicht löslich in Ether, Aceton, Chloroform und in fetten Ölen und sehr schwer löslich in Glycerin. Es bildet mit Ethanol farblose Lösungen, aus denen sich, wenn Wasser hinzugegeben wird, der Campher wieder abscheidet. Die Dichte beträgt 0,96 g/cm3. Campher ist leicht flüchtig und sublimiert schon bei Zimmertemperatur. Er verbrennt mit rußender Flamme. Beim Campher ist die molare Schmelzpunkterniedrigung auffällig groß, sie beträgt 39,7 K·(kg/mol). So verflüssigt sich Campher bereits, wenn er in Kontakt mit Menthol, Naphthol oder Chloralhydrat kommt. Der spezifische Drehwinkel beträgt +48°.
Bei der Reduktion von (+)-Campher [(1R,4R)-Campher] mit Natriumborhydrid oder Lithiumaluminiumhydrid entstehen zu 95 % Isoborneol [(1R,2R,4R)-Isoborneol] und zu 5 % dessen Stereoisomer Borneol [(1R,2S,4R)-Borneol]:
-Camphor_Reduction_V.1.svg.png)
Campher ist schwach wassergefährdend (WGK 1).
Sicherheitstechnische Kenngrößen
Campher bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 77 °C. Der Explosionsbereich liegt zwischen 0,6 Vol.‑% (38 g/m3) als untere Explosionsgrenze (UEG) und 4,5 Vol.‑% (280 g/m3) als obere Explosionsgrenze (OEG). Die Zündtemperatur beträgt 460 °C. Der Stoff fällt somit in die Temperaturklasse T1.
Wirkungen und Nebenwirkungen
Campher wirkt auf das zentrale Nervensystem und die Niere, in höheren Dosen auch (analeptisch) auf das Atemzentrum. Er ist durchblutungsfördernd und schleimlösend, kann aber auch zu Übelkeit, Angst, Atemnot und Aufgeregtheit führen. In Überdosis oral eingenommen, kommt es zu Verwirrtheits- und Dämmerzuständen, Depersonalisation, extremen Déjà-vu-Erlebnissen, Panik und akuten tiefgreifenden Störungen des Kurzzeitgedächtnisses bis hin zu Amnesie und epileptischen Anfällen. Die tödliche Dosis für einen Erwachsenen liegt bei 0,1 g/kg Körpermasse. Der Metabolismus geht zunächst zum vom Campher abgeleiteten Alkohol 2-Borneol, welcher in der Leber weiter zum Glucuronid umgewandelt wird. Dieses wird schließlich über den Harn ausgeschieden.
Verwendung
Chemische Produkte
Campher wird in Feuerwerkskörpern, teilweise in Sprenggelatine und in Mottenabwehrmitteln verwendet. Außerdem wird er für die Celluloidproduktion und als Weichmacher für Celluloseester verwendet.
Biologische und physikalische Anwendungen
In der Bienenpflege findet Campher als von der EU zugelassener Wirkstoff gegen Milbenbefall Anwendung. Er wird oftmals auch in entomologischen Sammlungen zur Desinfektion und zum Schutz vor Schädlingen genutzt. Auch in Sturmglasbarometern findet er Verwendung.
Wegen seiner hohen kryoskopischen Konstanten von 39,7 K·(kg/mol) wurde Campher früher zur Bestimmung der Molmasse nach Beckmann genutzt.
Medizin und Kosmetik

Campher ist in Kosmetik- und Medizinpräparaten enthalten, zum Beispiel in Produkten gegen Muskelzerrungen, Rheuma oder Neuralgien, Aftershaves wie Pitralon, in Mitteln gegen Erkältungen (beispielsweise enthält Wick VapoRub 5 % Campher) und in der Zahnmedizin zur Desinfektion infizierter Wurzelkanäle. Früher wurde er auch als Analeptikum verwendet, heute seltener aufgrund der Wirkungen auf das Herz und den Kreislauf.
Gestreckt wurde Campher im Mittelalter durch Beimischung von „Firnis“.
Genuss- und Rauschmittel, Lebensmittel
Seltene Fälle der Verwendung von Campher als Rauschmittel sind bekannt. Die Wirkungen beim Inhalieren von Campher zeigen sich in Lachanfällen trotz Schmerzen in den Atemwegen. Campher findet noch Verwendung in Schnupftabak aus England, wohingegen er in Deutschland laut Tabakverordnung zu den in Tabak verbotenen Stoffen zählt und nicht hinzugefügt werden darf. Historisch wurde er in China als geschmacks- und strukturverstärkender Zusatz in Speiseeis verwendet. In der EU ist D(+)-Campher durch die Verordnung (EG) Nr. 1334/2008 (Aromenverordnung) mit der FL-Nummer 07.215 als Aromastoff für Lebensmittel zugelassen.
Religiöse Praxis
Allein oder in Verbindung mit Baumharzen und/oder anderen Stoffen wird er als Räucherwerk beim Räuchern verwendet. Ferner werden im Islam die Verstorbenen während der letzten Waschung häufig mit Waschwasser gereinigt, dem zur Parfümierung Campher beigemischt ist.
Pharmakologische Eigenschaften und Anwendungen
Campher wird in 2,5%iger Lösung bei hypotonen oder orthostatischen Dysregulationen zur peroralen bzw. oro-mukosalen Gabe (über die Mundschleimhaut) eingesetzt. Außerdem wird es äußerlich in Form 10%iger Salben angewendet, höhere Konzentrationen können zu schweren Vergiftungen führen. Die Salben wirken durchblutungsfördernd und werden bei chronischer Arthritis, Sehnenscheidenentzündung, traumatischer Schwellung, Myalgie, Bursitis, Zerrung, Verstauchung und entzündlichem Ödem eingesetzt. Konzentrationen von 0,1 % haben eine geringe lokalanästhetische und durch Reizung von Kälteempfindungen leitenden Nervenendigungen kühlende Wirkung. Campher wird schnell über die Haut resorbiert und gelangt über das Blutplasma vor allem in das Fettgewebe. Es passiert die Blut-Hirn-Schranke, die Blut-Milch-Schranke und die Plazentaschranke. Die Metabolisierung erfolgt zu Carbonsäuren und/oder Campheralkoholen, teilweise wird der Wirkstoff glukuronidiert. Die Ausscheidung erfolgt vor allem über die Niere, in geringer Menge auch über die Lunge, den Kot und die Milch.
Campher ist das älteste Analeptikum und gehört zu den Parasympatholytika. Analeptika steigern in geeignetem Dosisbereich die Aktivität bestimmter Abschnitte des Zentralnervensystems. Campher entfaltet seine analeptische Wirkung durch das Blockieren von nikotinischen Cholin-Rezeptoren. Die pharmakologische Anwendung von Campher wird heute als obsolet bezeichnet. Die früher übliche Anwendung von Campher zusammen mit Pentetrazol (Markenname Cardiazol) in der Cardiazolschocktherapie als Krampfbehandlung von Geisteskrankheiten erlebte einen Höhepunkt um 1938. Sie wurde vom Psychiater Ladislas J. Meduna entdeckt und propagiert.
Gewinnung und Darstellung
Campher kann synthetisch hergestellt, aber auch durch Wasserdampfdestillation und Kristallisation aus zerkleinerten Pflanzenteilen des Campherbaums gewonnen werden. Natürlicher Campher ist meistens rechtsdrehend [(+)-Campher, „Japancampher“]. In Matricariaarten findet sich aber auch linksdrehender (–)-Campher („Matricariacampher“). Heutzutage wird Campher technisch ausgehend von α-Pinen synthetisiert. Über das intermediäre Carboniumion entsteht dabei hauptsächlich das thermodynamisch stabilere Isobornylacetat, welches in der Folge nach Hydrolyse des Esters zu (–)-Campher oxidiert wird.
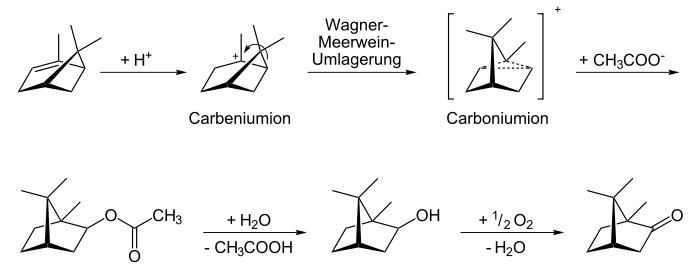
Die Totalsynthese von Campher gelang Gustaf Komppa 1903 (Razemat) bzw. 1905. Schon zuvor (1902) wurde bei Schering in Berlin unter Leitung von Ossian Aschan Campher in industrieller Synthese aus Terpentinölen (Pinenen) synthetisiert.
Biosynthese
Aus Geranylpyrophosphat über Cyclisierung von Linalool-Pyrophosphat zu Bornyl-Pyrophosphat gefolgt von einer Hydrolyse zu Borneol und anschließender Oxidation entsteht Campher enzymatisch im Salbei (Salvia officinalis).
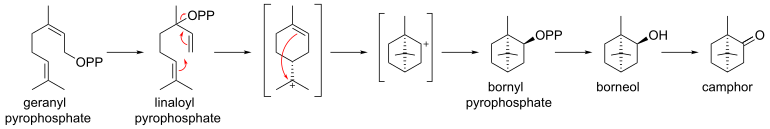


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.02. 2026




