Calciumoxalat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 375 mg/kg (LD50, Ratte, oral) | ||||||
Calciumoxalat ist ein Calciumsalz der Oxalsäure. Es besitzt die Summenformel CaC2O4 und gehört zur Stoffgruppe der Oxalate.
| Strukturformel | ||
|---|---|---|
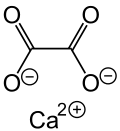
| ||
| Allgemeines | ||
| Name | Calciumoxalat | |
| Andere Namen |
| |
| Summenformel | CaC2O4 | |
| Kurzbeschreibung | farblose Kristalle (Monohydrat) | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
|
|
| EG-Nummer | 209-260-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 128,10 g/mol 146,12 g/mol (Monohydrat) | |
| Aggregatzustand | fest | |
| Dichte | 2,12 g/cm3 (Monohydrat) | |
| Schmelzpunkt | 200 °C (Kristallwasserabgabe) | |
| Löslichkeit | praktisch unlöslich in Wasser | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −1360,6 kJ/mol | |
Vorkommen


In der Natur kommt Calciumoxalat als Hauptbestandteil von Nierensteinen und Bierstein vor. Darüber hinaus kommt es in vielen Pflanzen als Fraßverteidigung vor (so z.B. in der Schild-Ampfer, Schmerwurz, Pastinaken, Taro und in Dieffenbachien und anderen Aronstabgewächsen). Auch im Gewebe von Kakteen sammelt sich Calciumoxalat. So besteht 85 % der Trockenmasse in Cephalocereus senilis aus Calciumoxalat. Die Kristallform des Calciumoxalats in den Pflanzenzellen ist meistens prismatisch mit spitzen Winkeln oder sternförmig (Drusen). Seltener zeigt sich ein nadeliger Kristallhabitus. Bündel aus nadelförmigen Calciumoxalat-Kristallen werden in der Botanik als Raphiden bezeichnet (nach griech. rhaphis: Nadel), sie kommen nur in einigen systematischen Gruppen vor und haben dadurch diagnostischen Wert in der Systematik. Neben diesen biologischen Quellen kommt Calciumoxalat in der Natur in Hydratform als die seltenen Mineralien Whewellit und Weddellit vor. Das Mineral des Trihydrats heißt Caoxit.
Gewinnung und Darstellung
Calciumoxalat ist ein Zwischenprodukt bei der Herstellung von Oxalsäure. Dabei wird Natriumoxalat mit Calciumhydroxid in das schwerlösliche Calciumoxalat überführt, aus dem die Oxalsäure mit Schwefelsäure freigesetzt wird.
Kristallstrukturen
Wasserfreies Calciumoxalat existiert nicht als Einkristall, sondern wird durch Erhitzen aus den Hydraten gewonnen. Dessen Kristallstruktur wurde deshalb durch Röntgenbeugung am kristallinen Pulver bestimmt und zeigt monokline Symmetrie mit der Raumgruppe P2/m (Raumgruppen-Nr. 10). Calciumoxalat-Monohydrat kristallisiert ebenfalls im monoklinen Kristallsystem. Bei Raumtemperatur ist die Raumgruppe P21/n (Nr. 14, Stellung 2) und oberhalb von 328 K wird die Raumgruppe zu I2/m (Nr. 12, Stellung 3). Calciumoxalat-Dihydrat kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe I4/m (Nr. 87). Calciumoxalat-Trihydrat kristallisiert im triklinen Kristallsystem mit der Raumgruppe P1 (Nr. 2).
Chemische Eigenschaften
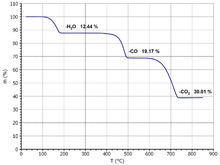
Calciumoxalat ist ein farbloses Salz der Oxalsäure. Die Verbindung bildet ein stabiles Monohydrat. Beim Erhitzen wird ab 110 °C zunächst das Kristallwasser abgegeben. Oberhalb von 300 °C zerfällt die Verbindung unter Freisetzung von Kohlenmonoxid und der Bildung von Calciumcarbonat. Dieses zersetzt sich beim weiteren Erhitzen oberhalb von 500 °C in Calciumoxid und Kohlendioxid.
Alle drei Reaktionschritte verlaufen endotherm. In Gegenwart von Luftsauerstoff erfolgt die zweite Reaktionsstufe als exotherme Oxidationsreaktion unter der Bildung von Kohlendioxid.
Mit einem Dihydrat und einem Trihydrat sind noch zwei weitere, metastabile Hydrate bekannt.
Verwendung
Calciumoxalat dient als Nachweis für Calciumionen. Gibt man eine oxalathaltige Lösung zur zu bestimmenden calciumhaltigen Lösung, fällt das schwer lösliche Calciumoxalat aus. Weiterhin dient es als Bleichmittel und findet als Metallreiniger Verwendung. Es wird auch als Glanzschicht auf der Oberfläche von Natursteinen erzeugt.
Calciumoxalat-Monohydrat wird in der Thermogravimetrie zur Kalibrierung von Thermowaagen verwendet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.11. 2023
