
Butan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | 2400 mg/m3, 1000 ml/m3 | |||||||
| Toxikologische Daten | ||||||||
Butan, auch n-Butan ist ein gasförmiges farbloses Alkan, das die geradkettige (CH3–CH2–CH2–CH3) Form der beiden Strukturisomere der Butane (Summenformel C4H10) darstellt. Natürliches Butangas besteht hauptsächlich aus n-Butan. Das verzweigte Isomer Isobutan mit der Halbstrukturformel CH(CH3)3 wird auch als Methylpropan bezeichnet und kommt in der Natur wesentlich seltener vor.
| Strukturformel | ||
|---|---|---|
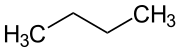
| ||
| Allgemeines | ||
| Name | Butan | |
| Andere Namen | ||
| Summenformel | C4H10 | |
| Kurzbeschreibung | farbloses, fast geruchsloses Gas | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 203-448-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 58,12 g/mol−1 | |
| Aggregatzustand | gasförmig | |
| Dichte |
| |
| Schmelzpunkt | −138,3 °C | |
| Siedepunkt | −0,5 °C | |
| Dampfdruck | 208 kPa (20 °C) | |
| Löslichkeit | sehr schlecht in Wasser (61 mg/l bei 20 °C) | |
| Dipolmoment | 0 | |
Eigenschaften
Butan ist bei Raumtemperatur und Normaldruck gasförmig und hat einen Schmelzpunkt von −138 °C und einen Siedepunkt von −0,5 °C. Butan kristallisiert in der monoklinen Raumgruppe P21/c (Raumgruppen-Nr. 14).[1][2] Butan ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend bis erstickend. In Wasser ist Butan nahezu unlöslich (90 mg/l). Butan hat einen Flammpunkt von −60 °C und eine Zündtemperatur von 365 °C. Der Explosionsbereich von -Butan liegt in Luft zwischen der unteren Explosionsgrenze (UEG) von 1,4 Vol.-% (33 g/m3) und der oberen Explosionsgrenze (OEG) von 9,4 Vol.-% (231 g/m3). Der Heizwert liegt bei 12,69 kWh/kg, dies entspricht 32,31 kWh/m3. Das Volumen ist als Normkubikmeter bei einer Temperatur von 0 °C und einem Druck von 101,325 kPa zu verstehen.
Bromwasser und Kaliumpermanganatlösung werden durch Butan nicht entfärbt. Mit den Halogenen Chlor und Brom reagiert Butan – wie andere Alkane auch – gewöhnlich nicht. Unter Lichteinfluss bildet sich jedoch photochemisch durch eine Radikalkettenreaktion ein Gemisch verschiedener Chlorbutane bzw. Brombutane.
Vorkommen
Butan ist ein sogenanntes Flüssiggas, das bei der Erdöldestillation anfällt. Es kommt im Erdöl und im Erdgas vor.
Reaktionen
Unter idealen Bedingungen oxidiert Butan zu Kohlenstoffdioxid und Wasser.
Verwendung
Butan wird zur Herstellung von 1,3-Butadien und Maleinsäureanhydrid und seit dem FCKW-Verbot als Treibgas in Sprays verwendet. Innerhalb der Europäischen Union ist es als Lebensmittelzusatzstoff E 943a zugelassen.[3] Im Gemisch mit wechselnden Anteilen Methylpropan und / oder Propan wird Butan als Brenngas („Flüssiggas“) zum Heizen und Kochen in Tanks und Gasflaschen sowie in Feuerzeugen eingesetzt. Als Treibstoff für Busse und Autos dient butanhaltiges Flüssiggas ebenfalls. Weiterhin dient Butan in der Kältetechnik als Kältemittel mit der Bezeichnung R600.
Gebrauch als Droge
Butan wird als Droge verwendet. Die Wirkung ist mit ähnlichen Schnüffelstoffen zu vergleichen[4] und wird primär von Jugendlichen gesucht.
Beim Konsum kann es zu einer Sauerstoffunterversorgung kommen, da sich das dichtere Butan in der Lunge absetzt und somit das nutzbare Lungenvolumen abnimmt. Es kann zu Übelkeit, Erbrechen und im schlimmsten Fall zu erheblichen Hirnschädigungen führen. Lebensgefahr besteht bei Erhöhung des Gehirndrucks. Durch Senkung der Krampfschwelle kann die Krampfanfälligkeit gesteigert werden. Psychische Abhängigkeit ist möglich. In geschlossenen Räumen und Fahrzeugen kann es zudem zu einem hochexplosiven Gas-Luft-Gemisch kommen.[5]
Literatur
- Geert Oldenburg: Propan – Butan. Springer, Berlin 1955.
Einzelnachweise
- ↑ Roland Boese, Hans-Christoph Weiss, Dieter Bläser: The Melting Point Alternation in the Short-Chain-Alkanes:
Single-Crystal X-Ray Analyses of Propane at 30 K and ofn-Butane ton-Nonane at 90 K. In: Angewandte Chemie International Edition. 38, 1999, S. 988,
doi:
 10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.0.CO;2-0.
10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.0.CO;2-0.
- ↑ Visualisierung Räumliche Darstellung von Molekülen und Kristallstrukturen bei
 log-web.de,
log-web.de,
- ↑
 Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022
Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022
- ↑ Robert Ackermann:
 Der plötzliche Schnüffeltod. In:
die tageszeitung. 19. Juni 2008.
Der plötzliche Schnüffeltod. In:
die tageszeitung. 19. Juni 2008.
- ↑ Jugendamt Nürnberg (Hrsg.):
 Keine Flucht in die Sucht.
(PDF-Datei; 313 kB) Nürnberg 2009.
Keine Flucht in die Sucht.
(PDF-Datei; 313 kB) Nürnberg 2009.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025

