
Calciumcarbid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | 0,14 mg/m3[2] | ||||||||
Calciumcarbid, auch Calciumacetylid, ist das Calcium-Salz des Ethins und damit ein Acetylid. In reinem Zustand ist es ein weißer Feststoff. Im allgemeinen Sprachgebrauch wird Karbid meist gleichgesetzt mit Calciumcarbid.
Geschichte

Calciumcarbid wurde erstmals 1836 von Edmund Davy sowie 1862 von Friedrich Wöhler
dargestellt und 1862 von Marcellin Berthelot ausführlich beschrieben. Die labormäßige Calciumcarbid-Herstellung im
elektrischen Ofen erfolgte 1892 durch Thomas Willson in Amerika und durch Henri Moissan in Paris. Walter Rathenau entwickelte einen speziellen elektrischen Schmelzofen
(Patent ![]() GB190006038A.,
Patent
GB190006038A.,
Patent ![]() US676514A.), in dem mittels eines Lichtbogens Branntkalk (CaO)
und Koks zu Calciumcarbid umgesetzt wurden. Die Elektrochemischen Werke
in Bitterfeld waren im Frühjahr 1895 das erste Unternehmen in Deutschland, die mit dem sogenannten Rathenau-Ofen Calciumcarbid im großtechnischen Betrieb herstellte. In der Schweiz begann die industrielle Calciumcarbid-Gewinnung
nach dem Rathenau-Verfahren 1895 in der Aluminiumindustrie AG in Neuhausen, in Norwegen (Sarpsborg) und in Deutschland (Aluminium Industrie Aktiengesellschaft im badischen Rheinfelden) im Jahre 1898 aufgenommen.
Weitere Karbid-Fabriken nach dem Rathenau-Verfahren wurden in Finnland (Imatra) und Österreich (Matrei) errichtet.[6] In den USA begann die Produktion um dieselbe Zeit
in den Vorgängerorganisationen von Union Carbide, an die Willson sein Patent 1895 verkaufte und in Kanada durch von Willson gegründete Unternehmen. 1934 wurden weltweit rund 3 Millionen Tonnen, davon 600.000 Tonnen in Deutschland,
produziert.[7] Die Jahresproduktion fiel von 10 Millionen Tonnen in den 1960er-Jahren auf 2 Millionen Tonnen 2010.[8]
Ein bedeutender Produzent von Calciumcarbid in der zweiten Hälfte des 20. Jahrhunderts waren die Chemischen Werke Buna bei Schkopau, die über 1 Million
Tonnen der Substanz im Jahr herstellten[9].
US676514A.), in dem mittels eines Lichtbogens Branntkalk (CaO)
und Koks zu Calciumcarbid umgesetzt wurden. Die Elektrochemischen Werke
in Bitterfeld waren im Frühjahr 1895 das erste Unternehmen in Deutschland, die mit dem sogenannten Rathenau-Ofen Calciumcarbid im großtechnischen Betrieb herstellte. In der Schweiz begann die industrielle Calciumcarbid-Gewinnung
nach dem Rathenau-Verfahren 1895 in der Aluminiumindustrie AG in Neuhausen, in Norwegen (Sarpsborg) und in Deutschland (Aluminium Industrie Aktiengesellschaft im badischen Rheinfelden) im Jahre 1898 aufgenommen.
Weitere Karbid-Fabriken nach dem Rathenau-Verfahren wurden in Finnland (Imatra) und Österreich (Matrei) errichtet.[6] In den USA begann die Produktion um dieselbe Zeit
in den Vorgängerorganisationen von Union Carbide, an die Willson sein Patent 1895 verkaufte und in Kanada durch von Willson gegründete Unternehmen. 1934 wurden weltweit rund 3 Millionen Tonnen, davon 600.000 Tonnen in Deutschland,
produziert.[7] Die Jahresproduktion fiel von 10 Millionen Tonnen in den 1960er-Jahren auf 2 Millionen Tonnen 2010.[8]
Ein bedeutender Produzent von Calciumcarbid in der zweiten Hälfte des 20. Jahrhunderts waren die Chemischen Werke Buna bei Schkopau, die über 1 Million
Tonnen der Substanz im Jahr herstellten[9].
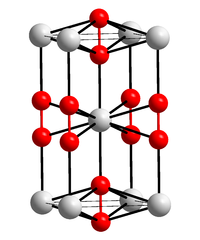
| Kristallstruktur | ||
|---|---|---|
| ||
| _ Ca2+ _–_ C≡C2− | ||
| Allgemeines | ||
| Name | Calciumcarbid | |
| Andere Namen |
| |
| Verhältnisformel | CaC2 | |
| Kurzbeschreibung | farblose Kristalle[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 200-848-3 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse | 64,10 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 2,22 g/cm3[2] | |
| Schmelzpunkt | 2160 °C[2] | |
| Siedepunkt | 2300 °C[2] | |
| Löslichkeit | Calciumcarbid ist in keinem Lösungsmittel unzersetzt löslich[1] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −59,8 kJ/mol[5] | |
Herstellung
.png)
Technisch wird Calciumcarbid in Schmelz-Reduktionsöfen (einer Sonderform des Lichtbogenofens) bei 2000 bis 2300°C aus Calciumoxid (Branntkalk) und Koks gewonnen. Durch den hohen Strombedarf dieser Öfen von 2800 bis 3500 kWh je Tonne Calciumcarbid[7] ist die Herstellung sehr kostenintensiv. Der Betrieb ist daher nur dort rentabel, wo sowohl die Rohstoffe als auch elektrischer Strom günstig zu beziehen sind, wie beispielsweise aus Wasserkraftwerken in wasserreichen Regionen.
Die dabei entstehenden braunen Brocken enthalten zu 80 bis 85 Prozent Calciumcarbid, der Rest besteht aus Verunreinigungen wie Calciumoxid, Calciumphosphid, Calciumsulfid, Calciumnitrid oder Siliciumcarbid.
Durch ein 2010 entwickeltes Verfahren wollte man einen Teil der eingesetzten Kohlen und Kokse durch Kunststoffabfälle (KBK) als Sekundärrohstoff ersetzen.[10]
Reineres Calciumcarbid kann durch Umkehrung der Bildungsreaktion von Calciumcyanamid oder durch Erhitzung eines Gemisches von Calciumcyanamid und Kohlenstoff im Hochvakuum gewonnen werden.[11]
Besonders reines Calciumcarbid kann aus den Elementen, also elementaren Calcium und Graphit oberhalb von 800 °C hergestellt werden.[11][12]
Eigenschaften
Physikalische Eigenschaften
In reinem Zustand ist Calciumcarbid eine farblose, kristalline Masse. Es existieren zwei Modifikationen, die tetragonale und eine kubisch flächenzentrierte Modifikation vom Pyrit-Typ, welche sich durch Erhitzen über 440 °C bildet.[11]
Das Calciumcarbid des Handels ist durch beigemengte Kohlebestandteile grau bis grauschwarz oder durch Eisenoxid-Verunreinigungen braun gefärbt; daneben enthält es durch die Herstellung bedingt noch etwas Calciumoxid, Calciumphosphid, Calciumsulfid, Ferrosilicium, Magnesiumnitrid und Siliciumcarbid, so dass es durchschnittlich nur auf einen CaC2-Gehalt von 82 % kommt.
Chemische Eigenschaften
Calciumcarbid gehört in der Gruppe der Carbide zu den Acetyliden, da es formal vom Ethin abgeleitet ist. Calciumcarbid ist in keinem Lösungsmittel (unverändert) löslich. Tritt es mit Wasser in Kontakt, so zersetzt es sich in einer lebhaften Reaktion (Hydrolyse) zu Ethin und Calciumhydroxid.
Der unangenehme „Carbid“-Geruch wird bei dieser Reaktion nicht von dem gebildeten Gas Ethin verursacht, sondern ist auf Gase wie Monophosphan, Ammoniak und Schwefelwasserstoff zurückzuführen, die bei der Reaktion der Verunreinigungen mit Wasser entstehen. So entsteht Monophosphan durch die Hydrolyse von im Calciumcarbid enthaltenem Calciumphosphid Ca3P2:
Bei Temperaturen oberhalb von 905 °C reagiert es mit Stickstoff unter Bildung von Calciumcyanamid, die Druckhydrierung liefert Calciumhydrid; seine reduzierenden Eigenschaften werden ebenfalls technisch genutzt.
Verwendung
Calciumcarbid reagiert im Gasgenerator mit Wasser zu Ethin (Gebrauchsname: Acetylen), das für verschiedene Anwendungen genutzt wird.[13]
- Synthese von Ethin, seinerseits ein Ausgangsstoff zur Herstellung von Grundchemikalien und Kunststoffen
- Betrieb von Karbidentwicklern (heute nur noch in Schwellenländern von Bedeutung[14])
- Früher wurde Calciumcarbid in Karbidlampen mit Wasser versetzt, mit dem es zu brennbarem Ethin reagierte; das Ethin wurde angezündet und verbrannte mit heller Flamme, weit heller als entsprechende Öl- oder Kerzenlampen. Dieses Verfahren wurde insbesondere in den Grubenlampen im Bergbau unter Tage verwendet. Karbidlampen wurden auch von Speläologen vor dem Aufkommen geeigneter LED-Lampen bevorzugt verwendet. Ab ca. 1900 bis weit in die 1930er-Jahre hinein wurden speziell für diesen Zweck produzierte Karbidlampen auch als Fahrradbeleuchtung eingesetzt.
- Herstellung von Kalkstickstoff
- Zum Entschwefeln von Roheisen und von Flüssigstahl in der Stahlindustrie
- Zur Bestimmung der Restfeuchte von Boden- oder Betonproben wird die Bildung von Ethin genutzt. Hierbei wird die Probe zusammen mit einer Ampulle Calciumcarbid und vier Stahlkugeln in eine genormte Stahlflasche gefüllt und mit einem Manometerkopf verschlossen. Die Flasche wird geschüttelt, wodurch die Probe weiter zerkleinert wird und die Calciumcarbidampulle zerbricht. Der durch die Reaktion von Calciumcarbid und Feuchtigkeit entstehende Gasdruck kann am Manometerkopf abgelesen und in den Feuchtegehalt umgerechnet werden. Dieses Verfahren wird als Carbid-Methode (CM) bezeichnet. Das Verfahren wird beispielsweise nach dem Verlegen des Estrichs angewendet, um festzustellen ob der Oberbelag bereits gelegt werden kann.
- Technisches Calciumcarbid wird als Wirkstoff in Repellents zur Vergrämung von Wühlmäusen und Maulwürfen eingesetzt. Das bei Kontakt mit der Bodenfeuchte entstehende Gasgemisch vertreibt die Tiere, ohne sie zu töten.[15][16]
Von den 1934 in Deutschland hergestellten Mengen wurden etwa 50–60 % für die Herstellung von Kalkstickstoff, 15–20 % für organische Synthesen, 20 % zum Schweißen und der Rest für Beleuchtungszwecke verwendet.[7]
Carbidschießen
Legt man einige Calciumcarbidstücke in eine Milchkanne und beträufelt man sie mit ein wenig Wasser, so entsteht in dem mit einem Deckel oder Fußball abgedichteten Volumen ein explosives Gasgemisch aus Ethin und Sauerstoff. Das Gasgemisch wird dann durch ein zuvor gebohrtes Loch im Boden entzündet. Durch die Explosion kann der Deckel oder Fußball bis zu 70 m weit geschleudert werden. Anders als bei der Kartoffelkanone ist die Richtung weniger vorhersagbar. Die Tradition des Carbidschießens wird vornehmlich in den Niederlanden und in einigen Teilen Nordwestdeutschlands und Nordbayerns von jungen Männern zu Hochzeiten, Silvester und Neujahr gepflegt. In der Oberlausitz ist es als Osterschießen bekannt. Im ostfriesischen Raum Deutschlands und den östlichen Landesteilen der Niederlande ist das Karbidschießen fester Bestandteil traditioneller Silvesterfeiern.[17] In Kärnten (Österreich) findet das Carbidschießen als Osterbrauch von der Speisesegnung am Karsamstag bis zur Auferstehungsfeier am Ostersonntag in der Früh statt.
Carbidfischen
Das gleiche Prinzip machten sich in der Hungerzeit nach dem Zweiten Weltkrieg zahlreiche Menschen zunutze, um trotz Dynamitfischerei-Verbot durch Explosion einer damals leicht verfügbaren Carbiddose in Fischgewässern viele Fische rasch töten und abräumen zu können.
Brenngas zum Schweißen
Karbid wurde bis etwa 1960 in großem Umfang verwendet, um in Karbidentwicklern bedarfsgerecht bei niedrigem Druck das hochenergetische Brenngas Acetylen (Ethin) zu erzeugen, das sich – in Verbindung mit Sauerstoff – durch eine besonders hohe Flammentemperatur einzigartig gut zum Schweißen (Gasschmelzschweißen) von Stahl (Eisenlegierungen) etwa zur Fertigung von Rohrleitungen im Bereich Gas/Wasser/Heizung eignet. Größere Gasentwickler gab es fest installiert in Werkstätten, kleinere für den mobilen Baustelleneinsatz. Karbid musste dafür vor Zutritt von Wasserdampf geschützt etwa in Blechdosen gelagert werden.
Dieses Verfahren der Erzeugung von Acetylen am Ort des Bedarfs war nötig, da sich Acetylen, würde man es zum Speichern in einer herkömmlichen Gasflasche komprimieren, folgenschwer unter gleichzeitiger Wärmeentwicklung zersetzen würde.
Erst mit der technischen Entwicklung der Acetylenflasche, in der dieses Gas unter mittelhohem Druck gelöst in einem Lösungsmittel sicher gespeichert werden kann, konnte die Gasversorgung auf Flaschen umgestellt und für den Nutzer vereinfacht werden. Acetylenflaschen enthielten lange krebserregenden Asbest und sind bis heute durch Lösemittel und poröse Stützmasse schwer und stoß- und hitzeempfindlich.
Einzelnachweise
- ↑ Hochspringen nach: a b Eintrag zu
 Calciumcarbid. In: Römpp Online.
Georg Thieme Verlag, abgerufen am 22. August 2025.
Calciumcarbid. In: Römpp Online.
Georg Thieme Verlag, abgerufen am 22. August 2025.
- ↑ Hochspringen nach: a b c
d Datenblatt
 Calciumcarbid (PDF)
bei Carl Roth, abgerufen am 22. August 2025.
Calciumcarbid (PDF)
bei Carl Roth, abgerufen am 22. August 2025.
- ↑ Hochspringen nach: a b Eintrag zu
 Calciumcarbid in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 22. August 2025. (JavaScript erforderlich)
Calciumcarbid in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 22. August 2025. (JavaScript erforderlich)
- ↑ Eintrag zu Calcium acetylide in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur
(ECHA), abgerufen am 22. August 2025. Hersteller bzw. Inverkehrbringer
können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Ursula Mader, Walther Rathenau: Direktionszeit für die „Elektrochemischen Werke“ (1893-1907). Zur Industriegeschichte der Bitterfelder Region. Heft 8, 2000, S. 16 f.
- ↑ Hochspringen nach: a b c O. Nicodemus: Die
neuere Entwicklung der Acetylenchemie im Hinblick auf die nationale Rohstoffversorgung, insbesondere auf Kautschuk und Kunststoffe. In: Angewandte Chemie. 49. Jahrgang,
Nr. 44. Frankfurt a. M./Höchst 31. Oktober 1936, S. 787–794,
doi:
 10.1002/ange.19360494402.
10.1002/ange.19360494402.
- ↑ M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6, S. 383.
- ↑ Herbert Hübner: Die naturale, humane und soziale Dimension der Technologie am Beispiel der Carbidproduktion. In:
Sitzungsberichte der Leibniz-Sozietät der Wissenschaften zu Berlin. 99. Jahrgang, 2008, S. 249–257
(
 leibnizsozietaet.de [PDF]).
leibnizsozietaet.de [PDF]).
- ↑
 Carbid mit Kunststoffabfällen produzieren
(im Internet Archive), BINE Informationsdienst – Projektinfo 08/2011.
Carbid mit Kunststoffabfällen produzieren
(im Internet Archive), BINE Informationsdienst – Projektinfo 08/2011.
- ↑ Hochspringen nach: a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 931–932.
- ↑ Knapp, M.; Ruschewitz, U.: Structural Phase Transitions in CaC2. In: Chem. Eur. J. 7 (2001) 874–880.
- ↑ Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 263.
- ↑
 CSB
Issues Safety Bulletin, Releases Findings and Recommendations in 2005 Acetylene Services Company (ASCO) Explosion that Killed Three in Perth Amboy, NJ. U.S. Chemical Safety and Hazard Investigation Board, 26. Januar 2006,
abgerufen am 22. August 2025 (englisch).
CSB
Issues Safety Bulletin, Releases Findings and Recommendations in 2005 Acetylene Services Company (ASCO) Explosion that Killed Three in Perth Amboy, NJ. U.S. Chemical Safety and Hazard Investigation Board, 26. Januar 2006,
abgerufen am 22. August 2025 (englisch).
- ↑ Andreas Vietmeier:
 Wühlmäuse (Schermäuse) im Garten. In:
Landwirtschaftskammer Nordrhein-Westfalen Pflanzenschutzdienst, abgerufen am 22. August 2025.
Wühlmäuse (Schermäuse) im Garten. In:
Landwirtschaftskammer Nordrhein-Westfalen Pflanzenschutzdienst, abgerufen am 22. August 2025.
- ↑
 Zulassungsbericht Prontox-Wühlmausgas.
Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, abgerufen am 22. August 2025.
Zulassungsbericht Prontox-Wühlmausgas.
Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, abgerufen am 22. August 2025.
- ↑ Robert Mohr, Timo Sager:
 „Der Gerät“
lässt es ordentlich krachen. In: Ostfriesen-Zeitung. 31. Dezember 2018, abgerufen am 22. August 2025.
„Der Gerät“
lässt es ordentlich krachen. In: Ostfriesen-Zeitung. 31. Dezember 2018, abgerufen am 22. August 2025.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.08. 2025


