Ethylenglycol
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | DFG/Schweiz: 10 ml/m3 bzw. 26 mg/m3 | |||||||
| Toxikologische Daten |
| |||||||
(Mono-)Ethylenglycol (MEG, Trivialname Glycol) ist der einfachste zweiwertige Alkohol mit der chemischen Bezeichnung Ethan-1,2-diol. Es ist das einfachste vicinale Diol. Der Trivialname leitet sich von süß-schmeckend (griechisch glykys ‚süß‘) ab.
Die Bezeichnung Glycole wird darüber hinaus für zwei Klassen von Diolen, die sich vom Ethylenglycol ableiten, verwendet. Das sind zum einen 1,2-Diole wie 1,2-Propandiol und zum anderen α,ω-Diole, die durch Kondensation von Ethylenglycol entstehen: Polyethylenglycole. Beispiele sind Diethylenglycol (DEG), Triethylenglycol (TEG).
Gewinnung und Darstellung
Technische Herstellung
Die großtechnische Herstellung von Ethylenglycol erfolgt meistens durch die katalysatorfreie Hydratisierung von Ethylenoxid bei Temperaturen von 150–200 °C und Drücken von 20–40 bar.
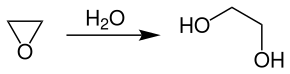
Die Umsetzung wird in adiabatisch betriebenen Rohrreaktoren durchgeführt. Man arbeitet mit einem 10–20 fachem molaren Überschuss an Wasser, um die Bildung von höheren Glykolen zu unterdrücken (vor allem Diethylenglycol und Triethylenglycol). Die Aufarbeitung und Trennung der Komponenten aus dem Produktgemisch erfolgt für gewöhnlich durch mehrstufige Destillation in Rektifikationskolonnen.
Des Weiteren kann die Hydratisierung auch mit sauren oder basischen Katalysatoren bei niedrigen Temperaturen (50–70 °C) und drucklos durchgeführt werden.
| Strukturformel | |
|---|---|
| Allgemeines | |
| Name | Ethylenglycol |
| Andere Namen |
|
| Summenformel | C2H6O2 |
| Kurzbeschreibung | farblose, viskose Flüssigkeit mit süßlichem Geschmack |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 107-21-1 |
| EG-Nummer | 203-473-3 |
| ECHA-InfoCard | 100.003.159 |
| PubChem | 174 |
| Eigenschaften | |
| Molare Masse | 62,07 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 1,11 g/cm3 (20 °C) |
| Schmelzpunkt | −16 °C |
| Siedepunkt | 197 °C |
| Dampfdruck |
|
| pKs-Wert | 15,1 (25 °C) |
| Löslichkeit | mischbar mit Wasser, Ethanol und Aceton |
| Brechungsindex | 1,4318 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −460,0 kJ/mol (l) −392,2 kJ/mol (g) |
OMEGA-Prozess der Royal Dutch Shell
Eine Weiterentwicklung dieses Verfahrens ist der OMEGA-Prozess der Royal Dutch Shell. Hierbei wird das Ethylenoxid zunächst mit Kohlenstoffdioxid in Wasser zum Ethylencarbonat umgesetzt. Dieses hydrolysiert dann mit Wasserdampf zum 2-Hydroxyethylhydrogencarbonat, welches anschließend durch Decarboxylierung in Wasser zu Ethylenglycol und Kohlenstoffdioxid zerfällt. Letzteres wird nach Aufbereitung wieder zur ersten Reaktionsstufe zurückgeführt.
.svg.png)
Die Ausbeute an Ethylenglycol beträgt in diesem Prozess ca. 99 %. Als Katalysatoren dienen hierbei Gemische von Kaliumiodid (KI) und Kaliummolybdat (K2MoO4).
Die Produktionskapazitäten für Ethylenglycol betrugen im Jahre 2010 weltweit etwa 25 Millionen Jahrestonnen.
Eigenschaften
Physikalische Eigenschaften
Ethylenglycol ist bei Raumtemperatur eine farblose, viskose Flüssigkeit. Der Schmelzpunkt liegt bei −16 °C. Unter Normaldruck siedet die Verbindung bei 197 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 9,6, B = 3225 und C = 283 im Temperaturbereich von 53 °C bis 198 °C.
Ethylenglycol besitzt bei 20 °C eine Viskosität von 20,81 mPas. Bei 30 °C sinkt die Viskosität auf 13,87 mPas.
Bei Verwendung als Kühlflüssigkeit schwankt die Wärmekapazität je nach Wasserzusatz von 2,4 bis 4,2 kJ/(kg·K) für reines Wasser. Ein 50/50-Gemisch friert bei −40 °C, siedet bei 108 °C und erreicht eine Wärmekapazität von 3,5 kJ/(kg·K). Es bildet, abweichend von anderen Glycolethern, mit Wasser kein Azeotrop.
Chemische Eigenschaften
Ethylenglycol zersetzt sich bei Luftzutritt am Siedepunkt und setzt dabei unter anderem Glycolaldehyd, Glyoxal, Acetaldehyd, Methan, Formaldehyd, Kohlenstoffmonoxid und Wasserstoff frei.
Ethylenglycol wirkt schwach korrosiv auf Eisenrohre.
Sicherheitstechnische Kenngrößen
Ethylenglycol bildet oberhalb des Flammpunktes bei 111 °C entzündbare Dampf-Luft-Gemische. Die untere Explosionsgrenze liegt bei 3,2 Vol.‑% (80 g/m³), die obere Explosionsgrenze (OEG) im Bereich von 43 bis 51 Vol.‑% (1090 – 1326 g/m³). Der unteren Explosionspunkt beträgt 109 °C. Mit einer Zündtemperatur von 410 °C resultiert eine Temperaturklasse T2. Mit einer elektrische Leitfähigkeit von 1,16·10−4 S·m−1 bzw. einem spezifischen Widerstand von 8,62·103 Ω·m−1 ist Ethylenglycol entsprechend der TRGS 727 als noch leitfähig anzusehen.
Verwendung
Es wurde 1928 von der I.G. Farben in Ludwigshafen als frostsichere Kühlflüssigkeit für Verbrennungsmotoren entwickelt und unter dem Markennamen Glysantin vertrieben.
(Mono)Ethylenglycol dient heute hauptsächlich zur Herstellung von Polyesterfasern und Polyethylenterephthalat, einem Polyester aus stöchiometrischen Mengen Terephthalsäure und Ethylenglycol mit 100 % Veresterungsgrad. 45 % der weltweit produzierten Menge werden in China verarbeitet.
Wegen seiner hydrophilen Eigenschaften findet es als Absorptionsmittel für die Entfernung von Wasserdampf aus Erd- und Raffineriegas oder Kreislaufgasen der Hydroraffination Anwendung. Auf allen Verkehrsflughäfen werden Glycol-Wasser-Gemische als Enteisungsmittel für Flugzeuge und Verkehrsflächen genutzt.
In der Forschung wird Ethylenglycol als Lösungsmittel und Reduktionsmittel für die Flüssigphasensynthese von eindimensionalen Metallnanostrukturen verwendet.
Sicherheitshinweise
- Die Hautdurchgängigkeit von Ethylenglycol ähnelt der von Ethanol und Glycerin. Ethylenglycol wird sehr schwer durch die intakte Haut aufgenommen. Rötung oder Entzündung kann auftreten, bei Kontakt von Augen oder Schleimhäuten können Reizeffekte empfunden werden.
- Wegen des geringen Dampfdrucks kann es praktisch nur als Aerosol oder Dampf von heißen ethylenglycolhaltigen Produkten eingeatmet werden.
- Bei oraler Aufnahme von 30 ml oder mehr handelt es sich um eine schwere, bei mehr als 100 ml um eine lebensbedrohliche Intoxikation. Das BfR gibt für Menschen eine toxische Dosis von 0,1 ml/kg Körpergewicht an.
Orale Toxizität
Die Symptome ähneln denen einer Methanolvergiftung ("gepanschter Alkohol"). Die Abbauprodukte sind jedoch vollkommen unterschiedlich. Wegen des süßen Geschmacks von wasserverdünnten Frostschutzmitteln sind Vergiftungen durch Ethylenglycol nicht ungewöhnlich. Für Erwachsene wird als Antidot die sofortige Aufnahme von Trinkethanol empfohlen (150 ml Whisky oder Weinbrand), klinisch wird 4-Methylpyrazol (Fomepizol) oder Ethanol i.v. gegeben.
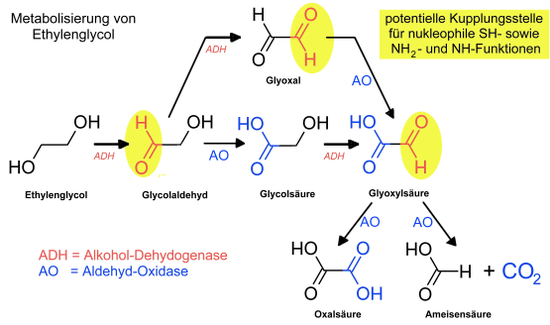
Zelltoxisch wirkt nicht das Ethylenglycol selbst, sondern dessen Metaboliten mit Aldehydfunktionen, Glycolaldehyd, Glyoxal und Glyoxylsäure. Diese reagieren mit allen Thiol- und Aminofunktionen von Enzymen und Proteinen. Das Enzym Alkoholdehydrogenase (ADH) katalysiert diese Oxidationsschritte (Alkohol → Aldehyd). Die empfohlenen Antidote wirken als kompetitive Hemmer der Alkoholdehydrogenase. Das Enzym Aldehydoxidase (AO) steuert den langsamen Oxidationsschritt (Aldehyd → Carbonsäure).
Unbehandelt verläuft die Vergiftung in drei Stadien über erste Symptome (Schwindel, Trunkenheit, Bewusstseinsstörungen), Schäden an Herz und Leber (nach 12–24 Stunden) bis zum urämischen Koma mit akutem Nierenversagen. Typische Abbau- und Folgeprodukte wie Glycolsäure, Hippursäure und Oxalsäure werden nachgewiesen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.10. 2025