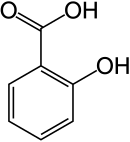
Salicylsäure
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| Toxikologische Daten | |||||||||||
Salicylsäure oder Salizylsäure (auch o-Hydroxybenzoesäure) ist ein chemischer Stoff mit fiebersenkender (antipyretischer) sowie schmerzlindernder (analgetischer) Wirkung. Salicylsäure kommt in Form ihres Methylesters in ätherischen Ölen und als Pflanzenhormon in den Blättern, Blüten und Wurzeln verschiedener Pflanzen vor und ist für die pflanzliche Abwehr von Pathogenen von Bedeutung. Ihren Namen bekam sie, da sie früher vor allem durch die oxidative Aufbereitung von Salicin, das in der Rinde verschiedener Weiden (wissenschaftlich Salix spec.) enthalten ist, gewonnen wurde.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Salicylsäure | |
| Andere Namen | ||
| Summenformel | C7H6O3 | |
| Kurzbeschreibung | farb- und geruchlose, kratzend süß-säuerlich schmeckende Kristalle mit unangenehmem Nachgeschmack | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-712-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 138,12 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,44 g/cm3 | |
| Schmelzpunkt | ||
| Siedepunkt | 211 °C (27 hPa) | |
| pKS-Wert |
| |
| Löslichkeit |
| |
Sie ist auch unter dem Namen Spirsäure bekannt, da sie aus dem Saft der Spierstaude (Mädesüß) gewonnen werden kann. Von der Bezeichnung Spirsäure leitet sich auch der Markenname Aspirin für die Acetylsalicylsäure ab: Acetylspirsäure. Die Salze der Salicylsäure heißen Salicylate.
Geschichte
Der italienische Chemiker Raffaele Piria isolierte die Salicylsäure erstmals 1838 aus dem von Johann Andreas Buchner 1819 aus der Weidenrinde isolierten Glucosid Salicin nach der Oxidation des primären Produkts Salicylalkohol. Der deutsche Chemiker Hermann Kolbe erkannte 1853 anhand des Zerfalls der Verbindung in Phenol und Kohlendioxid ihre Zusammensetzung und entwickelte hieraus im Jahre 1859 die nach ihm benannte Synthese der Salizylsäure. Salizylsäureverbindungen in Form neuer oder neuentdeckter Antipyretika brachten in der zweiten Hälfte des 19. Jahrhunderts Fortschritte in der Fieberbehandlung.
Vorkommen und Gewinnung
Biosynthese
Salicylsäure kommt in einer Vielzahl von Pflanzen vor und wirkt dort als Phytohormon. Es existieren zwei kompartimentierte Wege der Biosynthese: Der Phenylpropanoidweg im Cytoplasma ausgehend von Phenylalanin und der Isochorismatweg in den Chloroplasten. Meist liegt die Salicylsäure methyliert als flüssiges Methylsalicylat vor, um als flüchtiges Derivat für den Langstreckentransport wirksam zu sein. In Tabakpflanzen und Arabidopsis thaliana zeigte sich, dass diese Form wichtig bei der systemisch erworbenen Resistenz ist. Zudem kann die Salicylsäure glykosyliert als inaktive Form in den Vakuolen gespeichert werden.
Technische Herstellung
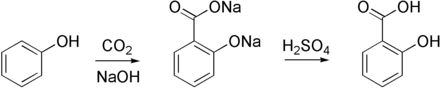
Technisch wird sie durch die Kolbe-Schmitt-Reaktion (vereinfacht auch als Salicylsäure-Synthese bezeichnet) aus Kohlenstoffdioxid und Natriumphenolat hergestellt. Diese künstliche Herstellung hat die Gewinnung aus Weidenrinde weitestgehend verdrängt.
Bereits 1874 wurde die Synthese der Salicylsäure nach einer Idee von Hermann Kolbe vom Labor in die fabrikmäßige Produktion übertragen, wobei der Schmitt-Schüler Friedrich von Heyden die Salicylsäurefabrik Dr. F. von Heyden in Dresden gründete, die ein Jahr später nach Radebeul übersiedelte. Von dort wurde die Salicylsäure als erstes industriell hergestelltes und „abgepacktes“ Medikament der Welt vertrieben. Friedrich von Heyden gilt als Gründer der industriellen Salicylsäureherstellung in der pharmazeutischen Industrie.
Chemisch-physikalische Eigenschaften

Die Salicylsäure zählt aufgrund des enthaltenen Benzolrings zu den Aromaten. Da sie eine Carboxy- und Hydroxygruppe enthält, gehört sie zu den Hydroxycarbonsäuren. Wegen der β-Ständigkeit der Carboxy- zur Hydroxygruppe kann sie auch als β-Hydroxycarbonsäure bezeichnet werden. Da die Hydroxygruppe direkt an den aromatischen Benzolring gebunden ist, gehört sie ebenfalls zu den Phenolen und damit auch zu den Phenolsäuren.
Bei schnellem, starkem Erhitzen decarboxyliert Salicylsäure unter Bildung von Phenol. Ab 76 °C sublimiert der Stoff teilweise, aus den abkühlenden Dämpfen entstehen nadelförmige Kristalle.
Die – im Vergleich zu anderen Hydroxybenzoesäuren – hohe Azidität liegt an der Stabilisierung des Salicylat-Anions durch eine Wasserstoffbrücke mit der benachbarten Hydroxygruppe.
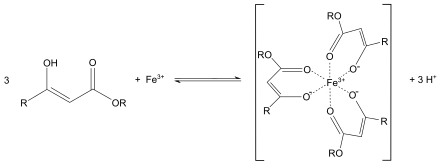
Analytischer Nachweis: Da Salicylsäure formal das Enol (in diesem Fall ein Phenol) einer β-Ketocarbonsäure darstellt, bildet sie mit Eisen(III)-chlorid-Lösung einen violett gefärbten Komplex, den Tris-Salicylat-Eisen(III)-Komplex:
Dieser Nachweis ist nicht spezifisch, da ähnliche Verbindungen wie Acetessigester die gleiche Reaktion aufweisen. Der Flammpunkt liegt bei 157 °C und die Zündtemperatur bei 570 °C.
Biologische Funktion
Als Phytohormon spielt die Salicylsäure eine wichtige Rolle als regulatorisches Signal bei abiotischem Stress wie Trockenheit und Hitze, Kälte oder osmotischem Druck. Zusätzlich ist sie für die Pflanze wichtig bei der Verteidigung gegen Pathogene, wird bei einem Befall sowohl lokal als auch systemisch exprimiert und ist in der Lage die Genexpression zu modulieren. Des Weiteren gibt es Hinweise, dass die Salicylsäure eine Rolle beim Wachstum und der Entwicklung der Pflanze spielt.
Verwendung

Salicylsäure dient zur Herstellung von Farb- und Riechstoffen und der Acetylsalicylsäure (ASS, auch bekannt unter dem Markennamen Aspirin), die als schmerzstillender, entzündungshemmender und gerinnungshemmender Arzneistoff Verwendung findet. In Form des unlöslichen Salzes Bismutsubsalicylat wird sie gegen Durchfall und Störungen des Gastrointestinaltraktes eingesetzt.
Weiterhin wird Salicylsäure als Flussmittel beim Weichlöten verwendet.
Die Salicylsäure besitzt eine antimikrobielle Wirkung, jedoch ist ihr Einsatz als Konservierungsstoff in Lebensmitteln verboten. In Kosmetika ist die Salicylsäure gemäß der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel als Antischuppenmittel in Haarspülmitteln bis maximal 3 %, für sonstige Mittel bis zu einer Konzentration von 2 % und bei Verwendung als Konservierungsstoff bis maximal 0,5 % zugelassen. In Arzneimitteln zeigt Salicylsäure ab 5%iger Lösung einen für die Aknetherapie ausreichenden kerato- und somit auch komedolytischen Effekt. Die Wirkung beruht auf dem Abbau von Talgpfropfen in den Follikeln der Epidermis. Zudem wirkt Salicylsäure entzündungshemmend auf die Haut und beeinflusst die Arachidonsäurekaskade positiv. In 10%iger Lösung wird sie zur Behandlung von Hühneraugen, Warzen und Hautpilzen eingesetzt.
Unerwünschte Wirkungen
Nebenwirkungen der Pharmakotherapie
Die Salicylsäure ist ein Metabolit der Acetylsalicylsäure, die im Organismus rasch hydrolysiert wird. Nebenwirkungen sind vor allem allergische Reaktionen, Blutungsneigung, Bronchokonstriktionen (Asthma bronchiale), Magenschleimhautschädigung mit Blutungen, in Einzelfällen Leberschädigung. Auch Harnsäureretention, Hyperurikämie und Nierenschädigung wurden beobachtet. Ein wichtiger Stoffwechselweg in der Leber führt über die Umwandlung in Salicylursäure.
Toxizität
Auf der Haut, für Schleimhäute und Augen wirkt Salicylsäure akut reizend bis gewebsschädigend. Weiterhin verursacht die Säure bei oraler oder sonstiger Einnahme eine Dämpfung des Atemzentrums und eine Störung wichtiger Stoffwechselprozesse sowie des Zentralnervensystems. Bei chronischer Einwirkung zeigen sich Störungen des Magen-Darm-Trakts. Im Tierversuch zeigte Salicylsäure bei oraler und dermaler Gabe verschiedenste Wirkungen auf Tiere (Katze, Maus, Kaninchen und Ratte) wie Schläfrigkeit, Muskelschwäche und Organschäden bei Leber und Nieren. Die akute Toxizität LD50 lag oral zwischen 400 und 1300 mg/kg, dermal bei der Ratte bei 2 g/kg. Beim Menschen wurden bei dermaler Verabreichung TDLo-Werte von 57 bis 111 mg/kg ermittelt. Die Plasmahalbwertszeit von Salicylsäure beträgt etwa 2–3 Stunden.
Sicherheitshinweise
Auf Vorschlag der Firma Novacyl wurde 2015 und 2016 die chemikalienrechtliche Einstufung von Salicylsäure überarbeitet. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) hat am 10. März 2016 die Einstufung für Salicylsäure wie folgt geändert: Salicylsäure wird als reproduktionstoxisch Repr 2 sowie Acut Tox 4 und Eye Dam 1 eingestuft. Die Warnhinweise wurden festgelegt auf H361d, H302 und H318. Diese Einstufung des RAC muss noch von der EU-Kommission in geltendes Recht umgesetzt werden, sie stellt aber mit der Veröffentlichung den Stand des Wissens dar, der von Unternehmen und Behörden berücksichtigt werden muss.
Derivate der Salicylsäure
Salze
Salicylsäure reagiert mit Natronlauge zu Natriumsalicylat.
Ester
Reagiert Salicylsäure mit einem Alkohol, so entsteht unter Wasserabspaltung ein Carbonsäureester bzw. ein Salicylsäureester. Sie kann auch mit organischen Säuren Ester bilden, wobei sie dann in der Reaktion als Alkohol fungiert. Salicylsäureester werden hauptsächlich in der Kosmetik- und Parfumindustrie als Antirheumatika in Badezusätzen, Salben oder Cremes, sowie als Riechstoffe und als UV-Filter in Sonnenschutzmitteln verwandt. Der wohl bekannteste Ester der Salicylsäure ist die Acetylsalicylsäure. Hier wurde die Hydroxygruppe der Salicylsäure mit der Carboxygruppe der Essigsäure verestert. Weitere relevante Salicylsäureester sind Salicylsäuremethylester, Salicylsäureethylester, Salicylsäurebenzylester, Salicylsäureisobutylester, Salicylsäureisopentylester, Salicylsäurephenylester und Salicylsäurehydroxyethylester.
Halogenderivate
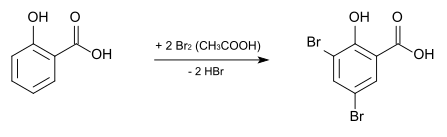
Durch Bromierung mit elementarem Brom in Eisessig entsteht die 3,5-Dibromsalicylsäure, deren Kupfersalz als Fungizid und Bakterizid eingesetzt wird.
Durch Iodierung mit Iodchlorid erhält man die biochemisch relevante 3,5-Diiodsalicylsäure. An der 4-Position halogenierte Salicylsäurederivate, wie 4-Iodsalicylsäure lassen sich nicht auf direktem Weg erhalten.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.09. 2025