CH-Acidität
-
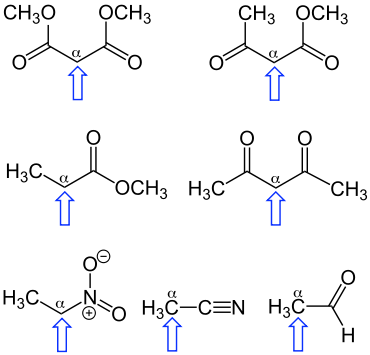 Auswahl CH-acider Verbindungen. Der blaue Pfeil weist jeweils auf das α-Kohlenstoffatom, an das die am meisten CH-aciden Wasserstoffatome (hier teilweise nicht explizit eingezeichnet) gebunden sind.
Auswahl CH-acider Verbindungen. Der blaue Pfeil weist jeweils auf das α-Kohlenstoffatom, an das die am meisten CH-aciden Wasserstoffatome (hier teilweise nicht explizit eingezeichnet) gebunden sind.
-
 Übersichtsreaktion CH-Acidität
Übersichtsreaktion CH-Acidität
CH-Acidität ist in der organischen Chemie die Neigung einer Verbindung, an einem Kohlenstoff-Atom gebundene Wasserstoff-Atome als Protonen abzugeben und damit formal als Säure zu agieren. Da Kohlenstoff selbst nicht sehr viel elektronegativer als Wasserstoff ist, ist die C-H-Bindung in der Regel, im Gegensatz zu N-H- und O-H-Bindungen, nicht sehr polar und die Bereitschaft, ein Carbanion zu bilden, dementsprechend gering. Dies führt zu sehr hohen pKS-Werten bei unsubstituierten Alkanen, z.B. pKS ca. 50 für Ethan. Ist das Kohlenstoffatom jedoch an stark elektronenziehende Gruppen wie Carbonyle (in einem Ester, Keton oder Aldehyd), Sulfone, Nitrile, Trifluormethyl- oder Nitrogruppen gebunden (α-ständig zu diesen Gruppen), so sorgt der stark ausgeprägte negative induktive Effekt dafür, dass die C-H-Bindung am α-Kohlenstoffatom stärker polarisiert und das Proton leichter abspaltbar wird.
Praktisch angewendet wird dies bei Reaktionen mit Enolaten, beispielsweise der Knoevenagel-Kondensation. Bei Einsatz von Derivaten der Malonsäure (pKS ≈ 13) oder Acetylaceton (pKS ≈ 9), die als β-Dicarbonyle recht gut deprotonierbar sind, können diese Reaktionen schon mit vergleichsweise milden Basen wie Ethanoaten oder Triethylamin durchgeführt werden.
Ebenso sorgen C-C-Mehrfachbindungen durch Annäherung der Kohlenstoffatome für eine stärkere Polarisierung, so dass Ethin mit einem pKS von ca. 25 relativ CH-acide ist und Acetylide, z. B. Silberacetylid, bilden kann.
Auch die Bildung eines aromatischen Systems kann die CH-Acidität steigern. Cyclopentadien beispielsweise hat einen pKs-Wert von 16. Es ist relativ stark CH-acid, weil das entstehende Cyclopentadienid-Anion als Aromat mesomeriestabilisiert ist, und beispielsweise als stabiler Komplexligand in Metallocen-Verbindungen auftreten kann.
Bedeutung
Dem pKS-Wert von CH-aciden Verbindungen kommt bei verschiedenen chemischen Verfahren und Prozessen eine hohe Bedeutung zu. So erhält man etwa durch die Deprotonierung der sehr schwach sauren Alkane sehr starke Basen, wie z.B. in Butyllithium. Andererseits nutzt man die hohe Säurestärke aktivierter Verbindungen (s.o.) um C-C-Verknüpfung durchzuführen. Auch wenn die CH-Acidität sehr gering ist, kann sie eine entscheidende Rolle bei chemischen Prozessen spielen, z. B. bei der Racemisierung von Hyoscyamin zu Atropin.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.05. 2025